Säure-Base Titrierung
Tutorial 5



 pH-Wert beim Titrieren einer starken Base mit einer starken Säure
Schema
pH-Wert beim Titrieren einer starken Base mit einer starken Säure
Schema
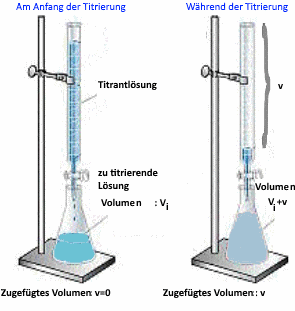
Bestimmung des Volumens $ V_e $ der am äquivalenten Punkt (P.E.) zugegebenen Säure
Am P.E.:
$n_{hinzugefügte\; Säure}= n_{Base am Anfang}$
$V_e\cdot c_{Säure}=V_i\cdot c_{Base}$
und so kriegt man $V_e$
pH-Wert je nach Volumen $ v $ zugegebener Säure
$v=0$
pH einer starke Base von der Molarität $c_{Base}$:
$pH=14+logc_{Base}$
$v\lt V_e$
Bestimmen der Anzahl der Mole Base $ n_b $, die noch nicht reagiert haben
$pH=14+log\frac{n_b}{V_i+v}$
$v\;=\;V_e$
$pH=7$
$v\gt V_e$
Bestimmen der Anzahl der Mole Säure $ n_a $ im Ãberschuss
$pH=-log\frac{n_a}{V_i+v} $
$0,196\;g\; KOH$ werden in Wasser gelöst und bilden $50\, ml$ Lösung.
$10\;mL$ dieser Lösung werden titriert mit $HCl\;0,050\;M$.
Berechnen Sie den pH-Wert nach Zugabe von $ 20 mL$ HCl.
Berechnen Sie zuerst die anfängliche Molarität von $KOH$ !
Für Antworten verwenden Sie die Pfeile ↑ und ↓ oben!
Beenden Sie bitte diese Frage, bevor Sie zur nächsten übergehen!
$c_{KOH}$ $=$ $\frac{0,196}{39,1\cdot 0,050}$ $=$ $0,10\;M$
Berechnen Sie das Volumen, das am P.E. hinzugefügt wurde.!.
$V_e$ $=$ $\frac{0,010\cdot 0,10}{0,050}$ $=$ $20\;mL$
Geben Sie den pH-Wert an !.
Wir sind am P.E., also:
$pH=7,0$



