







On fait réagir en milieu acide $1 \;mol$ d'un alcool avec $1\; mol$ d'un acide carboxylique. La constante d'équilibre vaut $K = 4$.
Calculer le nombre de moles d'ester obtenu à l'équilibre.
Appelez x le nombre de moles d'ester obtenu et remplissez ensuite le tableau suivant:
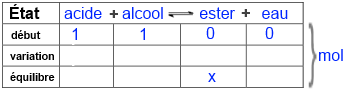
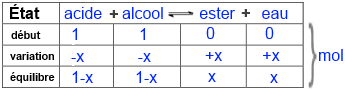
Introduisez dans l'expression de la constante d'équilibre $K$ !
$4$ = $\frac{n_{ester}n_{eau}}{n_{acide}n_{alcool}}$= $\frac{x\cdot x}{(1-x) \cdot (1-x)}$
Résoudre l'équation ainsi obtenue!
$\frac{x\cdot x}{(1-x) \cdot (1-x)}=4$ $\frac{x^2}{(1-x)^2}=4$ $(\frac{x}{1-x})^2=4$ $\frac{x}{1-x}=2$ (les nombres de moles sont positifs, la solution négative -2 est donc à rejeter) $x=\frac{2}{3}$ Nombre de moles d'ester obtenus = $\frac{2}{3}$