



Voici une solution $0,200 M$ de $H_3C_6H_5O_7$ (acide citrique, $K_a$ $=$ $3,5 \cdot 10^{-4}$)
Equilibre d'hydrolyse:
$H_3C_6H_5O_7$ $+$ $H_2O$ $H_3O^+$ $+$ $H_2C_6H_5O_7^-$
$H_3O^+$ $+$ $H_2C_6H_5O_7^-$
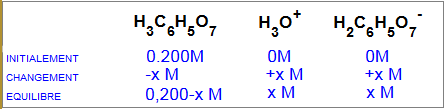
Substituez maintenant les concentrations à l'équilibre dans l'expression de la constante d'acidité $K_a$ ! Laquelle des suivantes est la substitution correcte?
a) $3,5 \cdot 10^{-4}$ $=$ $\frac{x(0,200-x)}{ x^2}$ b) $3,5 \cdot 10^{-4}$ $=$ $\frac{0,200-x }{ x^2}$ c) $3,5 \cdot 10^{-4}$ $=$ $\frac{x^2 }{ 0,200-x}$ d) $3,5 \cdot 10^{-4}$ $=$ $\frac{x^2 }{ x(0,200-x)}$
Pour les réponses, utilisez (éventuellement plusieurs fois) les flèches ↑ et ↓ en haut! Terminez s.v.pl. cette question avant de passer à la suivante!
La réponse c) est correcte, $3.5 \cdot 10^{-4} = \frac{x^2 }{ 0.200-x}$