







a) Dresser les formules contributives à la mésomérie du phénol !
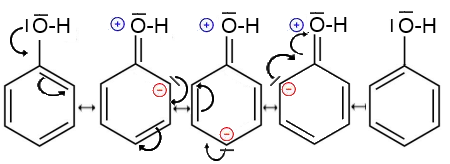
b) Pourquoi le phénol est-il un acide plus fort que le propan-2-ol?
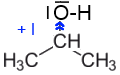
Du fait de la mésomérie, le phénol possède une charge partielle positive sur l'atome $O$. Cette charge renforce la polarité de la liaison $O-H$ et facilite ainsi la rupture hétérolytique de cette liaison et donc le départ de $H^+$. Dans le cas du propan-2-ol, l'effet $I\;+$ exercé par le groupement isopropyle affaiblit la polarité de la liaison $O-H$ et rend le départ de $H^+$ plus difficile:
c) Dresser les formules contributives à la mésomérie de la benzaldéhyde !
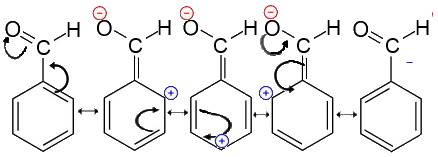
d) Pourquoi le phénol se prête-t-il plus facilement à des substitutions électrophiles que la benzaldéhyde ?
Dans le phénol, le noyau aromatique est enrichi en électrons du fait de sa mésomérie, alors que dans la benzaldéhyde c'est le contraire.