

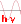





À côté de l'effet photoélectrique, un autre fait inexpliqué au début du 20e siècle était...
Si on prend comme source de lumière des corps simples portés à haute température, il apparaît des raies dans le spectre visible de cette lumière.

D'où peuvent bien provenir ces raies?

Niels Bohr
Le physicien danois Niels Bohr réfléchissait au sujet des raies spectrales de l'hydrogène. Chaque raie devait provenir d'un photon de longueur d'onde fixe émis par l'atome. D'après la formule de Planck $E_{photon}$ $=$ $h\nu\;(7)$ l'énergie de tous les photons produisant une raie donnée devait être rigoureusement la même. Mais d'où venait cette énergie et pourquoi était-elle la même? Bohr supposait que l'atome H disposerait d'orbites circulaires où l'électron pourrait tourner en rond. Sur chaque orbite, cet électron aurait ainsi une énergie bien déterminée, sur une orbite éloignée du noyau une énergie $E_2$ plus élevée que l'énergie $E_1$ sur une orbite rapprochée du noyau. (En effet pour passer de l'orbite éloignée vers l'orbite rapprochée, l'électron devrait effectuer un travail sous l'influence de la force d'attraction du noyau et donc perdre de l'énergie.) Bohr supposait en outre que ce serait justement en tombant d'une orbite éloignée du noyau sur une orbite proche du noyau que l'énergie ainsi perdue $E_2-E_1$ serait dégagée vers l'extérieur de l'atome sous forme d'un photon
:
Saut quantique de l'électron de la 4e orbite sur la 1ère
Bohr se proposa de retrouver le spectre expérimental de l'atome d'hydrogène en raisonnant sur son hypothèse: Il fallait déterminer l'énergie de l'électron sur chaque orbite. Ensuite, il serait facile de retrouver la position des raies à l'aide la formule de Planck. La physique classique conduisait Bohr aux considérations suivantes:
Force de Coulomb entre électron et noyau de l'atome :
Le noyau de l'atome H est constitué d'un seul proton. Il possède la charge $e$ $=$ $1,6\cdot 10^{-19}C$. L'électron a la charge $-e$ $=$ $-1,6\cdot10^{-19}C$. Ces deux charges sont distantes de $r$ = rayon de l'orbite où se trouve l'électron. L'électron est donc attiré du noyau avec la force de Coulomb: $F_1$ $=$ $k\frac{e^2}{r^2}$, avec $k$ $=$ $9,0\cdot10^9\frac{Nm^2}{C^2}$
Force centrifuge qui s'exerce sur l'électron:
L'électron qui se déplace avec une vitesse $v$ sur une orbite circulaire de rayon $r$ subit une force centrifuge égale à: $F_2$ $=$ $\frac{mv^2}{r}$, avec $m$ $=$ $9,11\cdot 10^{-31} kg$
Energie de l'électron dans l'atome
L'énergie d'un système matériel est le travail (Force · déplacement) que ce système peut faire.
Energie potentielle:
Dans l'atome H le seul électron, situé à une distance $r$ d'un proton, possède de l'énergie, car il peut fournir du travail (Force de Coulomb $\cdot$ distance du noyau) en étant attiré par le noyau. Les physiciens montrent qu'on peut écrire cette énergie sous la forme: $E_{pot}$ $=$ $-k\frac{e^2}{r}$ Comme nous nous y attendons, nous voyons qu'en augmentant la distance du noyau, l'énergie augmente. À distance infinie du noyau, l'énergie potentielle est (arbitrairement) fixée à 0 ce qui constitue sa valeur maximale!
Energie cinétique
Dans l'atome H l'électron qui se déplace avec une vitesse v possède de l'énergie, car il peut par exemple déplacer une autre particule en se heurtant avec elle. Les physiciens montrent qu'on peut écrire cette énergie sous la forme: $E_{cin}$ $ =$ $ \frac{mv^2}{2}$
Une seule équation!
La physique classique ne fournit ainsi qu'une seule équation entre les inconnues $v$ et $r$ : Force de Coulomb = Force centrifuge $k\frac{e^2}{r^2}$ $=$ $\frac{mv^2}{r}$
Pour déterminer les valeurs de $v$ et $r$, il fallait trouver une deuxième équation entre ces inconnues faisant nécessairement intervenir le numéro $n$ de l'orbite. Comme Bohr savait par les spectres à quelles valeurs de $\Delta E$ il devait aboutir, il a délibérément cherché une deuxième équation menant à ces valeurs: $mvr$ $=$ $\frac{nh}{2\pi}\;(*)$ En la → combinant avec les équations précédentes, Bohr trouve le résultat suivant:
Énergie de l'électron sur l'orbite de numéro (quantique) $n$: $E_n$ $=$ $-\frac{A}{n^2}$ avec: $A$ $=$ $2,18\cdot 10^{-18}J\;(**)$
Voici un diagramme des états énergétiques (énergies de l'électron sur les différentes orbitales) dans l'atome d'hydrogène de Bohr:

Le passage de l'électron de l'état $n$ $=$ $n_2$ vers l'état $n$ $=$ $n_1$ cause une perte d'énergie (**) de: $E_{n_2}$ $-$ $E_{n_1}$ $ =$ $ A(\frac{1}{n_1^2}$ $-$ $\frac{1}{n_2^2})$ L'énergie est libérée sous forme d'un photon: $h\nu$ $ =$ $A(\frac{1}{n_1^2}$ $-$ $\frac{1}{n_2^2})$ d'où: $\nu$ $ =$ $\frac{A}{h}(\frac{1}{n_1^2}$ $-$ $\frac{1}{n_2^2})$ $\lambda$ $ =$ $\frac{c}{\frac{A}{h}(\frac{1}{n_1^2}-\frac{1}{n_2^2})}$
Pour le passage de $n_2$ $=$ $3$ vers $n_1$ $=$ $2$, cette dernière formule permet par exemple le calcul (!!) d'une longueur d'onde du photon de $\lambda$ = $\frac{3\cdot 10^8}{\frac{2,18\cdot 10^{-18}}{6,626\cdot 10^{-34}}(\frac{1}{2^2}-\frac{1}{3^2})}$ = $65,62\cdot 10^{-8}m$ = $656,2 nm$.
Il s'agit de la raie rouge observée (!!) sur le spectre visible de l'hydrogène! Les autres raies se déduisent également de la formule précédente.
La théorie de Bohr et surtout l'équation (*) ont joué un rôle important dans le développement de la mécanique ondulatoire qui allait s'appliquer à tous les édifices atomiques !