







Voici une solution $0,400\;M$ de $HN_3$
(acide hydrazoÏque, $K_a$ $=$ $1.9\cdot 10^{-5}$)
Equilibre d'hydrolyse:$HN_3$ $+$ $H_2O$  $H_3O^+$ $+$ $N_3^-$
$H_3O^+$ $+$ $N_3^-$
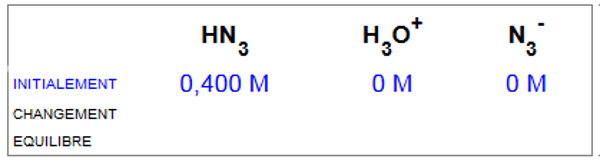
Quels sont les changements de concentration de chaque espèce?
a) +x M, -x M, +x M b) -x M, +x M, +x M c) +x M, +x M, +x M d) -x M, +x M, -x M
La réponse b) est correcte, car pour chaque mole d'acide qui se dissocie, il se forme une mole de chacun des ions.