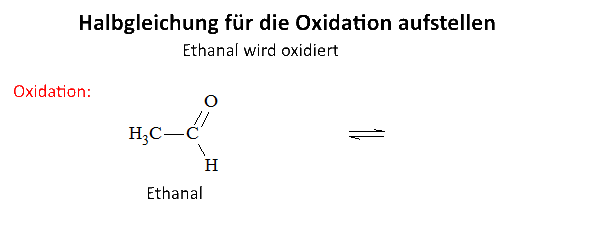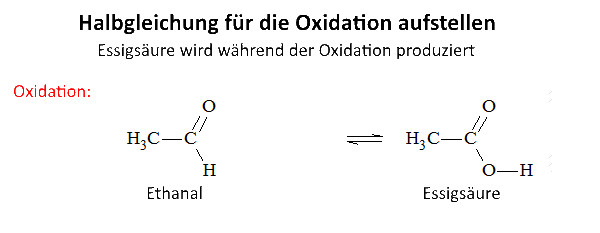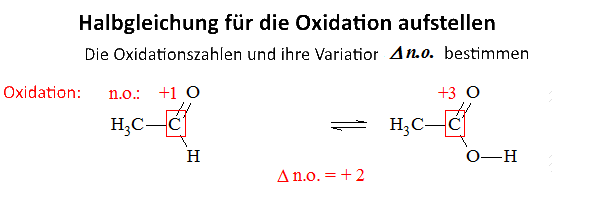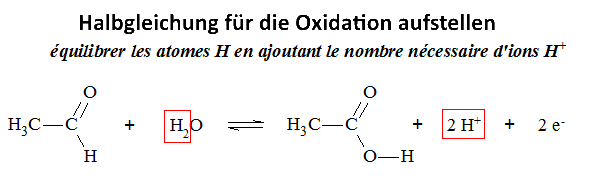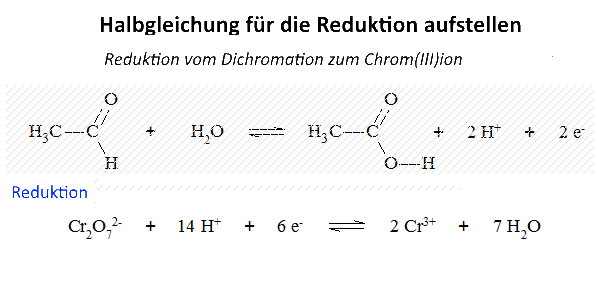Die Oxidationszahl ( O.Z.) eines Atoms in einem Molekül
Es ist eine fiktive Zahl. Es ist, als hätte das Atom die Elektronen der Bindung, in der es der elektronegativste Partner ist, vollständig erfasst oder die Elektronen der Bindung verloren, in der es der am wenigsten elektronegative Partner ist, und seine Ladung wird dann bestimmt: Sie ist dann die Oxidationszahl .
Sind die beiden Atome identisch, teilen wir uns die Bindungselektronen.
Beispiel:
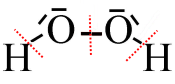
Hier haben wir jedem Atom $ O $ $7 e^- $ zugewiesen, während in seiner → ; neutralen Lewis-Struktur er nur 6 hat.
Seine fiktive Ladung (seine O.Z.) ist daher -1
Wir haben jedem $ H $ -Atom 0 $ e^- $ zugewiesen, während in seiner → neutralen Lewis-Struktur er 1 hat.
Seine fiktive Ladung (seine O.Z.) beträgt +1
Variation der O.Z.
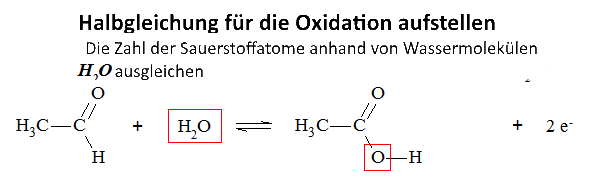
Wenn die O.Z. sich um n Einheiten erhöht,verliert die Species n $ e^- $
Wenn die O.Z. um n Einheiten animmtb, erhält die Species n $ e^- $
Man braucht die O.Z. von Atomen, die in einer ähnlichen Lage sind oder auch H -Atome auf einem anderen Atom nicht zu betrachten, z. B:

Untersuchen wir die Reaktion von Kaliumdichromat auf Ethanal (Acetaldehyd) in Gegenwart von Schwefelsäure: