





Wassermoleküle können Wasserstoffbrücken zum O-Atom der Carbonylgruppe bilden. Dies erklärt die Löslichkeit von Aldehyden und Ketonen in Wasser.
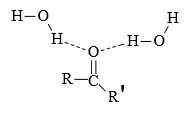
Die Löslichkeit ist jedoch geringer als die der entsprechenden Alkohole, die in Bezug auf Wasser sowohl Donoren als auch Akzeptoren von H-Brücken sind.


Keine $ H $ -Brücke bewirkt eine starke gegenseitige Anziehung von Aldehyden oder Ketonen (die Polarität der $ C-H $ -Bindung ist zu schwach!).
Diese Substanzen sind daher flüchtiger als Alkohole mit vergleichbarem Molekulargewicht.
Es bleibt die geringere Dipol-Dipol-Anziehung der Carbonylgruppen, die Siedetemperaturen gewährleistet, die dennoch höher sind als die der entsprechenden Kohlenwasserstoffe, die nur mit den schwachen Van-der-Waals-Kräften verbunden sind.
 Die Trägheit nimmt mit der Molmasse zu, so dass die Flüchtigkeit abnimmt:
Die Trägheit nimmt mit der Molmasse zu, so dass die Flüchtigkeit abnimmt:
 Wenn sich die $ C $ -Kette von Atomen ausdehnt, überwiegt der hydrophobe Charakter der Kohlenwasserstoffkette über den hydrophilen Charakter der Carboxylgruppe, und die Flüchtigkeit der Aldehyde und Ketone wird der der Kohlenwasserstoffe vergleichbarer Molmassen immer ähnlicher.
Wenn sich die $ C $ -Kette von Atomen ausdehnt, überwiegt der hydrophobe Charakter der Kohlenwasserstoffkette über den hydrophilen Charakter der Carboxylgruppe, und die Flüchtigkeit der Aldehyde und Ketone wird der der Kohlenwasserstoffe vergleichbarer Molmassen immer ähnlicher.
