





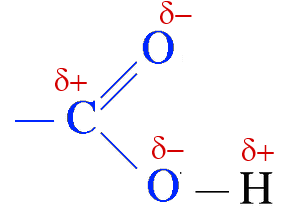
Das Zentrum (in Blau) der Carboxyl gruppe ist planar, die Bindungen der Hydroxyl $ OH $ und Carbonyl $ C = O $ Gruppe sind stark polar.
Das Wasser ist auch stark polar:
Die Wasser- und Carbonsäuremoleküle können sich somit zu Wasserstoffbrücken verbinden. Dies erklärt die perfekte Löslichkeit der kleinkettigen Carbonsäuren in Wasser.
 Sobald sich die $ C $ -Kette von Atomen ausdehnt, herrscht der hydrophobe (unpolare, "wasserfürchtende") Charakter der Kohlenwasserstoffkette über dem hydrophilen (polaren, "Wasser liebenden") Charakter der Hydroxylgruppe.
Sobald sich die $ C $ -Kette von Atomen ausdehnt, herrscht der hydrophobe (unpolare, "wasserfürchtende") Charakter der Kohlenwasserstoffkette über dem hydrophilen (polaren, "Wasser liebenden") Charakter der Hydroxylgruppe.

Zwei $ H $ -Brücken sorgen für eine starke gegenseitige Anziehung der Carbonsäuren. Ihre Trägheit ist die von Dimeren und die Siedetemperaturen sind hoch.
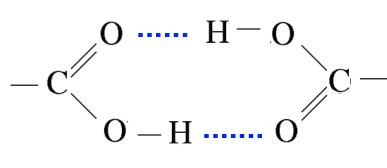
Ihre Flüchtigkeit ist geringer als die der Alkohole, die nur die zu assoziierende Hydroxylgruppe aufweisen, und viel geringer als die der Aldehyde, die sich nur durch die schwachen Dipole der Carbonylgruppe gegenseitig verbinden und auch der Alkane, die nur durch ihre schwachen van der Waals-Kräfte zusammengehalten werden.

Wenn sich die $ C $ -Kette von Atomen ausdehnt, überwiegt der hydrophobe Charakter der Kohlenwasserstoffkette über den hydrophilen Charakter der Carboxylgruppe, und die Flüchtigkeit der Carbonsäuren nähert sich der der Alkane vergleichbarer Molmassen an.:
