Suche:

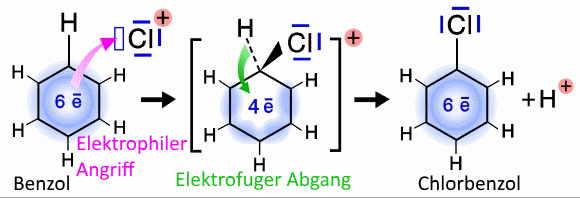
Ein Elektrophil kann ein Molekül oder ein Kation sein, das eine elektronische Lücke aufweist (nur 6 Elektronen in der letzten Schicht eines seiner Atome).
Ein nucleophiles Zentrum ist ein Teil eines Moleküls oder Anions, das ein Dublett aufweist das dem Elektrophil zur Verfügung gestellt werden kann, um eine Dativbindung zu bilden.
In diesem Fall hängt die Elektrophilie (Stärke des elektrophilen Charakters) von mehreren Faktoren ab:
1) Die Ladung :
Reagenzien, die eine oder mehrere positive Ladungen an der Lücke tragen, sind stärker elektrophil als ähnliche Reagenzien, die nur eine positive Teilladung oder keine positive Ladung am betreffenden Atom aufweisen.
Dies liegt daran, dass die positiven Ladungen das Dublett des nucleophilen Zentrums stärker anziehen! Nach absteigender Reihenfolge von Elektrophilien, findet man z.B.:
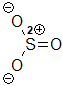 Schwefeltrioxid
Schwefeltrioxid
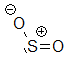 Schwefeldioxid
2) Die Electronégativität:
Weniger elektronegative Atome sind weniger elektrophil.
Dies liegt daran, dass weniger elektronegative Atome das Elektronendublett des nucleophilen Zentrums weniger stark anziehen! Beispiel: Absteigende Reihenfolge der Elektrophilie:
Schwefeldioxid
2) Die Electronégativität:
Weniger elektronegative Atome sind weniger elektrophil.
Dies liegt daran, dass weniger elektronegative Atome das Elektronendublett des nucleophilen Zentrums weniger stark anziehen! Beispiel: Absteigende Reihenfolge der Elektrophilie:
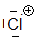 Chloronium
Chloronium
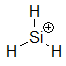 Wir sehen, dass die Elektrophilie in einer Periode des Periodensystems von rechts nach links abnimmt: $ Cl \gt Si $
3) Größe des Dublett-Trägeratoms :
Atome, die kleiner sind, sind elektrophiler als ähnliche Atome in derselben Familie.
Dies liegt daran, dass die kleineren Atome das elektronische Dublett des nucleophilen Zentrums stärker anziehen (Coulomb-Gesetz)! Beispiel: Absteigende Reihenfolge der Elektrophilie:
Wir sehen, dass die Elektrophilie in einer Periode des Periodensystems von rechts nach links abnimmt: $ Cl \gt Si $
3) Größe des Dublett-Trägeratoms :
Atome, die kleiner sind, sind elektrophiler als ähnliche Atome in derselben Familie.
Dies liegt daran, dass die kleineren Atome das elektronische Dublett des nucleophilen Zentrums stärker anziehen (Coulomb-Gesetz)! Beispiel: Absteigende Reihenfolge der Elektrophilie:
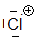 Chloronium
Chloronium
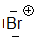 Bromonium
Wir sehen, dass die Elektrophilie in einer Familie des Periodensystems von oben nach unten abnimmt: $ Cl \gt Br $
4) Der Induktionseffekt der am lückentragenden Atom angebundenen Gruppen :
I + -Effektgruppen verringern die Elektrophilie. Tatsächlich pumpen sie die Elektronen in Richtung der Lücke. Diese neuen Elektronen neigen dazu, das elektronische Dublett des nucleophilen Zentrums abzustoßen! Das Gegenteil trifft für I- Effekt-Gruppen zu. Beispiel: Absteigende Reihenfolge der Elektrophilie:
Bromonium
Wir sehen, dass die Elektrophilie in einer Familie des Periodensystems von oben nach unten abnimmt: $ Cl \gt Br $
4) Der Induktionseffekt der am lückentragenden Atom angebundenen Gruppen :
I + -Effektgruppen verringern die Elektrophilie. Tatsächlich pumpen sie die Elektronen in Richtung der Lücke. Diese neuen Elektronen neigen dazu, das elektronische Dublett des nucleophilen Zentrums abzustoßen! Das Gegenteil trifft für I- Effekt-Gruppen zu. Beispiel: Absteigende Reihenfolge der Elektrophilie:
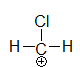 Chloromethylium
Chloromethylium
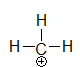 Methylium
Methylium
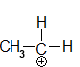 Ethylium
Ethylium
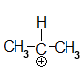 Prop-2-ylium
Die Methylgruppen, die an das die Lücke tragende C-Atom gebunden sind, haben einen $ I^+ $ - Effekt, das Chlor einen $ I^- $ - Effekt.
Prop-2-ylium
Die Methylgruppen, die an das die Lücke tragende C-Atom gebunden sind, haben einen $ I^+ $ - Effekt, das Chlor einen $ I^- $ - Effekt.

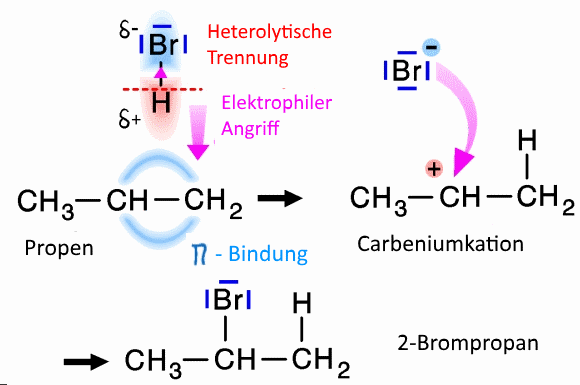
Ein Elektrophil kann ein Molekül sein, das eine permanent positive Teilladung hat (polares Molekül) oder eine temporäre Teilladung (polarisierbares Molekül). In diesem Fall muss er normalerweise einen Teil seines Moleküls aufgeben, um anzugreifen.
In diesem Fall hängt die Elektrophilie (Stärke des elektrophilen Charakters) von mehreren Faktoren ab:
1) Die Größe der Teilladung :
Reagenzien mit einer höheren positiven Teilladung sind bessere Elektrophile.
Dies liegt daran, dass die positiven Ladungen das Dublett des nucleophilen Zentrums stärker anziehen! Beispiel: Absteigende Reihenfolge der Elektrophilie:
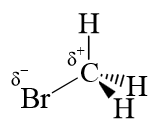
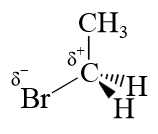 Im letzteren Fall verringert der $ I^+ $ - Effekt der Methylgruppe die Kohlenstoff-Partialladung.
2) Die Stabilität der ausgehenden Gruppe :
Je weniger die abgehende Gruppe basisch ist, desto stabiler ist sie mit dem Elektronenpaar, das sie trägt, und desto leichter kann sie fort!
Nach abnehmender Stabilität: $ H_2O \gt OH^- $ und $ I^- \gt Br^- \gt Cl^- $
In absteigender Reihenfolge der Elektrophilie finden wir zum Beispiel in vielen Reaktionen:
Im letzteren Fall verringert der $ I^+ $ - Effekt der Methylgruppe die Kohlenstoff-Partialladung.
2) Die Stabilität der ausgehenden Gruppe :
Je weniger die abgehende Gruppe basisch ist, desto stabiler ist sie mit dem Elektronenpaar, das sie trägt, und desto leichter kann sie fort!
Nach abnehmender Stabilität: $ H_2O \gt OH^- $ und $ I^- \gt Br^- \gt Cl^- $
In absteigender Reihenfolge der Elektrophilie finden wir zum Beispiel in vielen Reaktionen:
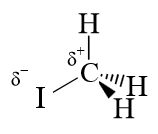 Iodomethan
Iodomethan
 Bromomethan
Wir sehen, dass die Stabilität der ausgehenden Gruppe ihre Elektronegativität manchmal überwiegt!
Es ist zu beachten, dass die oben aufgeführten Kriterien nur Angaben sind . Der Kontext der Reaktionen (Lösungsmittel, Temperatur, Art des Substrats ..) spielt manchmal eine entscheidende Rolle.
Bromomethan
Wir sehen, dass die Stabilität der ausgehenden Gruppe ihre Elektronegativität manchmal überwiegt!
Es ist zu beachten, dass die oben aufgeführten Kriterien nur Angaben sind . Der Kontext der Reaktionen (Lösungsmittel, Temperatur, Art des Substrats ..) spielt manchmal eine entscheidende Rolle.
Hier einige Beispiele: