






Anschließend bezeichnen wir durch $ x $ das Volumen (in $ mL $) von bereits hinzugefügtem $ HCl $ .
$c_B$ = $\frac{c_{Α}V_{Α}}{V_B}$ = $\frac{0,05\cdot 0,040}{0,020}$ = $0,10 \frac{mol}{L}$
1.
Die starke Base $ NaOH $ ist allein vorhanden, ihre Konzentration beträgt $c_B=0,10 \;M$ $pH=14+logc_B$ = $13$
2.
(Der Einfachheit halber betrachten wir die Substanzen zuerst so, als wären sie nicht dissoziiert)
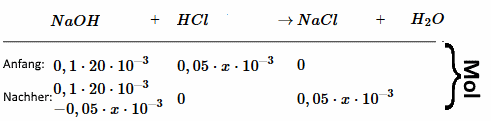
$c_{NaOH}$ = $\frac{n_{NaOH}}{(V_B+x)10^{-3}}$ = $\frac{0,1\cdot20\cdot10^{-3}-0,05\cdot x\cdot10^{-3}}{(20+x)10^{-3}}$ = $\frac{2-0,05\cdot x}{20+x}$ $pH$ $ =$ $ 14+log( \frac{2-0,05\cdot x}{20+x})$
3.
$HCl$ und $NaOH$ haben vollständig reagiert, bleibt eine neutrale Lösung von $NaCl$: $pH = 7$
4.

$c_{HCl}$ = $\frac{n_{HCl}}{(V_B+x)10^{-3}}$ = $\frac{0,05\cdot x\cdot10^{-3}-0,1\cdot20\cdot10^{-3}}{(20+x)10^{-3}}$ = $\frac{0,05\cdot x-2}{20+x}$ $pH$ $=$ $ -log( \frac{0,05\cdot x-2}{20+x})$
→ Hier finden Sie Simulationen von solchen Titrationen