





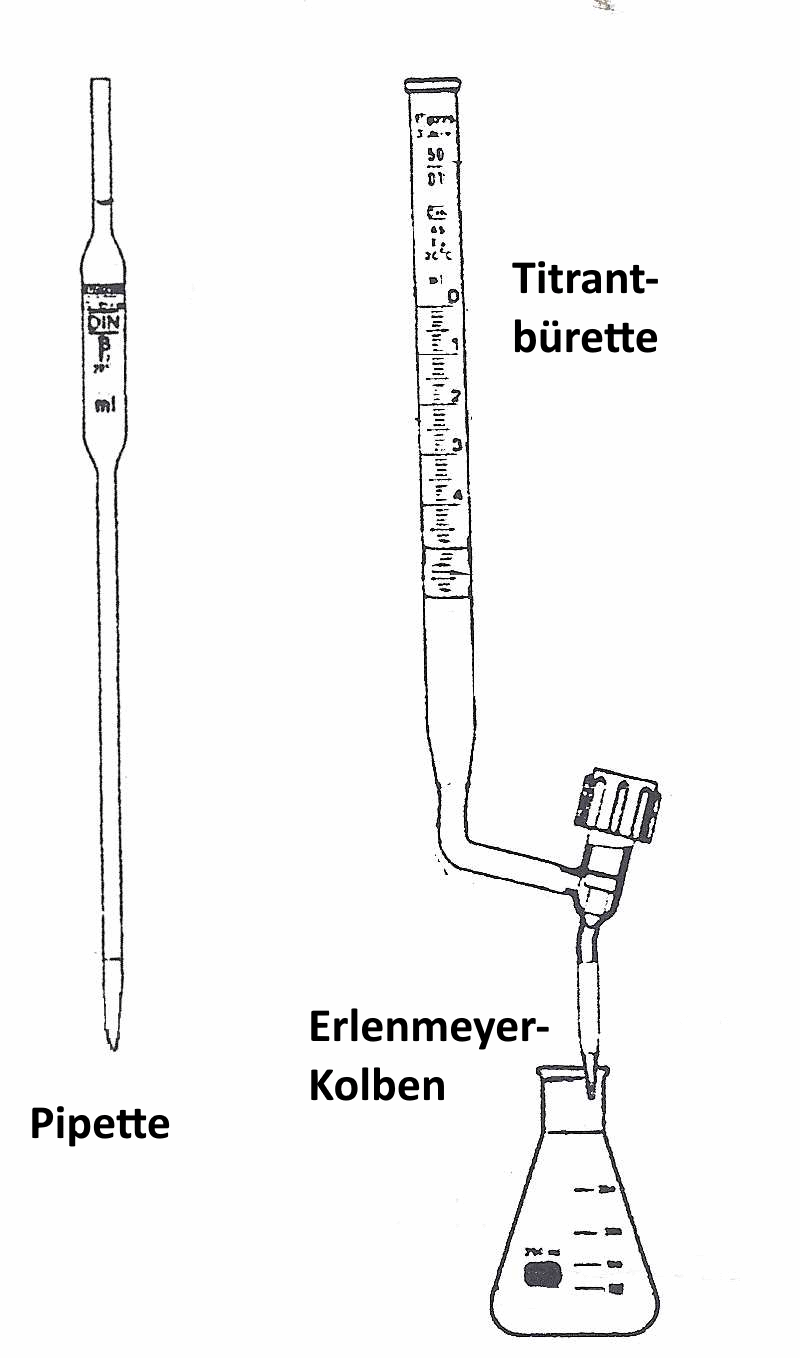
Pipette und Bürette werden gespült, bevor Lösungen verwendet werden, die später eingeführt werden.
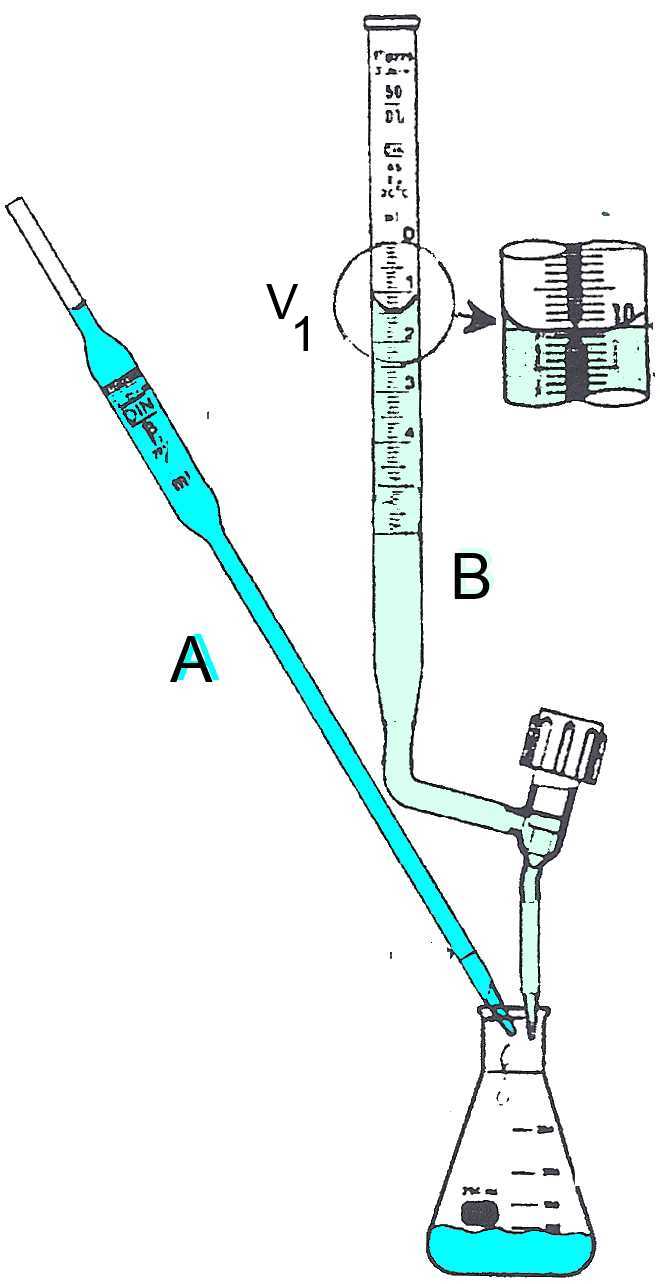
A: Säure- oder Base deren Konzentration bestimmt werden soll. Sein Volumen $ V_{Α} $ wird mit der Pipette gemessen. B: Base oder Säure bekannter Konzentration.
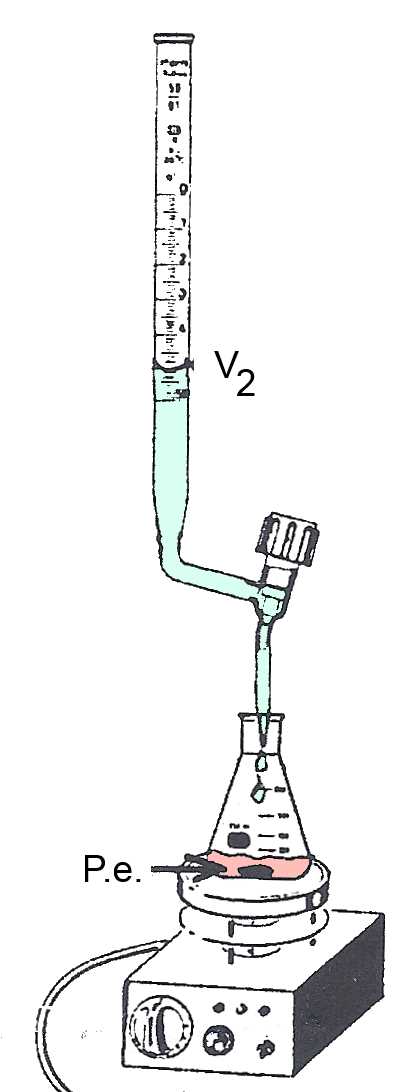
: Am Equivalenzpunkt P.e. hat B A vollständig neutralisiert. Der P.e. wird durch den Farbumschlag eines Farbindikators oder durch das pH-Meter erkannt. Zugegebenes Volumen von B , bis der P.e. erreicht ist: $ V_B = V_2- V_1$
Am P.e.: Die Anzahl an Molen an hinzugefügtem B ist gleich der Anzahl an Molen A, die vor der Zugabe von B vorhanden waren. $n_{Α} = n_B$ $c$A$V_{Α}=c_BV_B$
Im Beispiel: $c_{Α}$ $=$ $\frac{c_BV_B}{V_{Α}}$
Beispiel: In den Erlenmeyerkolben werden $20\; ml$ einer Lösung von $ HCl $ unbekannter Konzentration, genau gemessen mit der Pipette, eingebracht. Ein Tropfen Bromthymol wird zugegeben. Die Lösung nimmt eine gelbe Farbe an. In der Bürette wird eine Lösung von $ NaOH \; 0,10 \frac{mol}{L} $ eingeführt. Wir messen $ V_1 $ $ = $ $ 10,5 mL $. P.e. Die Lösung wird blau. Wir messen dann $ V_2 $ $ = $ $25,5\; mL $. Dann finden wir: $c_{Α}$ $ =$ $\frac{c_BV_B}{V_{Α}}$ $=$ $\frac{0,10\cdot(0,0255-0,0105)}{0,020}$ $= $ $0,075 \frac{mol}{L}$