





Anwendung des Massenwirkungsgesetzes auf das Autoprotolysegleichgewicht von Wasser:
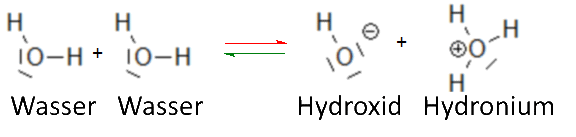
Es wird für jede Lösung gefunden, die diese drei Spezies enthält: $\frac{[OH^-][H_3O^+]}{[H_2O]}$ $=$ $K $ $[OH^-][H_3O^+]$ $=$ $K[H_2O] $ Die Gleichgewichtskonstante $ K $ hängt nur von der Temperatur ab, und solange wir uns auf niedrige Konzentrationen anderer Spezies in der wässrigen Lösung beschränken, bleibt $ H_2O $ annähernd konstant. $[OH^-][H_3O^+]$ $=$ $K_e $ Unter diesen Bedingungen ist $ K_e $ konstant (gilt für jede verdünnte Lösung bei einer gegebenen Temperatur und natürlich auch für reines Wasser). Die Werte $[OH^-]$=$[H_3O^+]$=$10^{-7}$ gültig für reines Wasser bei 25 ° C erlauben, $ K_e $ zu berechnen bei 25oC: $K_e=[OH^-][H_3O^+]=10^{-7}10^{-7}$
Bei 25oC: $K_e$ = $[OH^-][H_3O^+]$ $=$ $10^{-14}\frac{mol^2}{L^2}$ (Formel gültig für jede verdünnte wässrige Lösung !!)