





Als Energie einer chemischen Bindung (Dissoziationsenthalpie einer Bindung) wird die Enthalpievariation der Reaktion bezeichnet, die ein Mol solcher Bindungen dissoziiert.
Exemple:
Bei $ 25^oC$ und $ 1\;bar$ müssen $ 436\: kJ$ Wärme einem Mol Wasserstoffgas zugeführt werden, um es vollständig in zwei Mol Wasserstoffatome zu dissoziieren: $H_2(g)$ $\longrightarrow$ $2H(g)$ $\Delta H = +436\;kJ$ Die Bindungsenergie H-H (=die Enthalpie der Dissoziationsreaktion von $H_2$) = $436\;kJ$ !!
Die gleiche Art von Bindung wird oft in vielen Molekülen gefunden, zum Beispiel wird Bindung $ C-H $ in folgenden Molekülen gefunden $CH_4$, $C_2H_6$, $C_{10}H_{22}$ usw... Da die Umbebung jedes Mal ein wenig anders ist, ist die Enthalpie der Dissoziation leicht unterschiedlich. In die → Tabelle der Bindungsenergien schreibt man einen Mittelwert der verschiedenen gängigen Werten.
Die Energien vieler Bindungen sind bestimmt worden. Sie erlauben es, ungefähr die "Wärme der Reaktionen" vorherzusagen, unter der Voraussetzung, dass man die Bindungsenergien von Reagenzien und Produkten kennt. Lassen Sie uns grob die Wärme folgender Reaktion berechnen: $2H_2O(g)$ $+$ $2Cl_2(g)$ $\longrightarrow$ $4HCl(g)$ $+$ $O_2(g)$
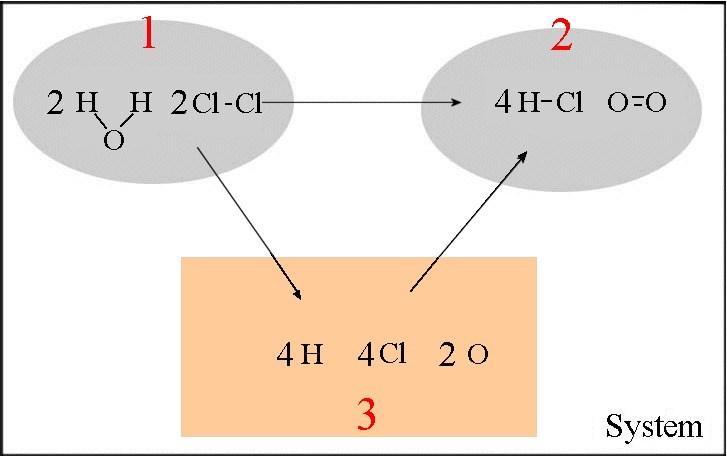
- Im orangefarbenen Rahmen sind die isolierten Atome - Die Transformationen $ 1 \rightarrow 3 $ und $ 2 \rightarrow 3 $ sind Dissoziationsreaktionen chemischer Bindungen! $\Delta H_{12}$ $=$ $\Delta H_{13}$ $+$ $\Delta H_{32} =$ $\Delta H_{13}$ $-$ $\Delta H_{23} =$ $(4\cdot E_{Bindung}(H-O)$ $ + $ $2\cdot E_{Bindung}(Cl-Cl))$ $ - $ $(4\cdot E_{Bindung}(H-Cl)$ $+$ $E_{Bindung}(O=O))$ $ =$ $4\cdot 465$ $+$ $2\cdot 243$ $ -$ $(4\cdot 431$ $ +$ $494)$ $ =$ $128\;kJ$
Beachten Sie das Ergebnis, das sich geringfügig von dem richtigeren unterscheidet welches für die gleiche Reaktion mit Formationsenthalpien berechnet wurde $(114,4\; kJ)$!
Die Bindungsenergie ist ein gutes Maß für die Beurteilung von "Stärke" Bindungen (= Bruchfestigkeit), beispielsweise im Wasserstoffperoxidmolekül, in dem Bindung O-O zerbrechlich ist:
