







Suche:
Ein Molekül ist eine viel kompliziertere Struktur als ein einzelnes Atom.
Physiker haben bewiesen, dass Molekülorbitale mit Atomorbitalen vorhersehbar sind:
 Zwei $ 1s $ -Orbitale (zum Beispiel aus zwei getrennten Wasserstoffatomen) enthalten jeweils ein Elektron (durch einen Pfeil symbolisiert).
Diese beiden Orbitale "verschmelzen" und bilden eine Bindung (z. B. $ H-H $).
Das Ergebnis ist ein neues Orbital eines neuen Moleküls. Dieses Molekülorbital heißt $ \sigma $ (sigma) und enthält die beiden Elektronen.
Zwei $ 1s $ -Orbitale (zum Beispiel aus zwei getrennten Wasserstoffatomen) enthalten jeweils ein Elektron (durch einen Pfeil symbolisiert).
Diese beiden Orbitale "verschmelzen" und bilden eine Bindung (z. B. $ H-H $).
Das Ergebnis ist ein neues Orbital eines neuen Moleküls. Dieses Molekülorbital heißt $ \sigma $ (sigma) und enthält die beiden Elektronen.
 Zwei $ 2p_y $ -orbitale, die sich dieselbe Achse teilen (z. B. in zwei getrennten Sauerstoffatomen), enthalten jeweils ein Elektron (durch einen Pfeil symbolisiert).
Diese beiden Orbitale "verschmelzen" und bilden eine Bindung z.B.$ O-O $ . Das Ergebnis ist ein neues Orbital eines neuen Moleküls. Dieses Orbital heißt immer noch $ \sigma $ (sigma) und enthält die beiden früheren Elektronen.
Beachtung! Die obige schematische Zeichnung enthält nur ein $ \sigma $ -Orbital!
Zwei $ 2p_y $ -orbitale, die sich dieselbe Achse teilen (z. B. in zwei getrennten Sauerstoffatomen), enthalten jeweils ein Elektron (durch einen Pfeil symbolisiert).
Diese beiden Orbitale "verschmelzen" und bilden eine Bindung z.B.$ O-O $ . Das Ergebnis ist ein neues Orbital eines neuen Moleküls. Dieses Orbital heißt immer noch $ \sigma $ (sigma) und enthält die beiden früheren Elektronen.
Beachtung! Die obige schematische Zeichnung enthält nur ein $ \sigma $ -Orbital!
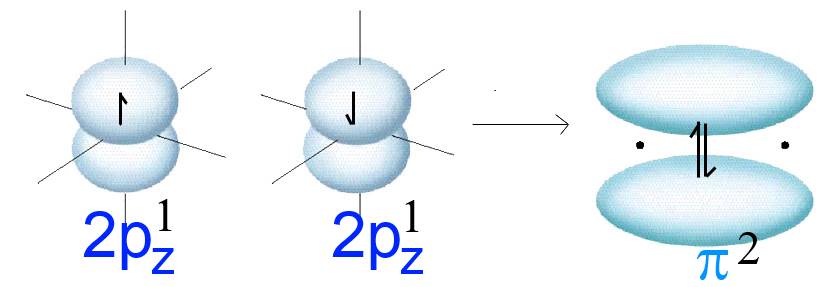 Zwei $ 2p_z $ -Orbitale mit parallelen Achsen (z. B. in zwei getrennten Sauerstoffatomen) enthalten jeweils ein Elektron (durch einen Pfeil symbolisiert).
Diese beiden Orbitale "verschmelzen" lateral und bilden eine weitere $ O-O $ -Bindung. Das Ergebnis ist ein neues Orbital eines neuen Moleküls. Dieses Orbital heißt $ \pi $ (pi) und enthält die beiden früheren Elektronen.
Beachtung! Die obige schematische Zeichnung enthält nur ein $ \pi $ -Orbital!
Zwei $ 2p_z $ -Orbitale mit parallelen Achsen (z. B. in zwei getrennten Sauerstoffatomen) enthalten jeweils ein Elektron (durch einen Pfeil symbolisiert).
Diese beiden Orbitale "verschmelzen" lateral und bilden eine weitere $ O-O $ -Bindung. Das Ergebnis ist ein neues Orbital eines neuen Moleküls. Dieses Orbital heißt $ \pi $ (pi) und enthält die beiden früheren Elektronen.
Beachtung! Die obige schematische Zeichnung enthält nur ein $ \pi $ -Orbital!