Suche:
In dem Hydroniumion (Hydroxoniumion) bildet das Sauerstoffatom 3 Bindungen mit H-Atomen.
Das einfache Modell der kovalenten Lewis-Bindung (so viele kovalente Bindungen wie ungepaarte Elektronen) muss erweitert werden, um diese Art von Ionen zu berücksichtigen:
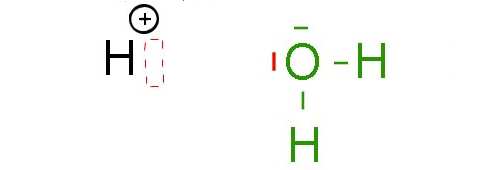 Hier ist ein Wasserstoffion und ein Wassermolekül.
Das Wasserstoffion hat auf seiner letzten Schicht Platz für zwei Elektronen. Tatsächlich ist die letzte Schicht des $H^+$-Ions leer, kann aber bis zu 2 Elektronen aufnehmen. Das $ H^+$ Ion hat eine Elektronenlücke .
Auf der anderen Seite hat das Sauerstoffatom des Wassermoleküls auf seiner letzten Schicht (zumindest) ein elektronisches Dublett. Der "Deal" ist nun folgender:
Hier ist ein Wasserstoffion und ein Wassermolekül.
Das Wasserstoffion hat auf seiner letzten Schicht Platz für zwei Elektronen. Tatsächlich ist die letzte Schicht des $H^+$-Ions leer, kann aber bis zu 2 Elektronen aufnehmen. Das $ H^+$ Ion hat eine Elektronenlücke .
Auf der anderen Seite hat das Sauerstoffatom des Wassermoleküls auf seiner letzten Schicht (zumindest) ein elektronisches Dublett. Der "Deal" ist nun folgender:
 Indem es die zwei Elektronen seines Dubletts mit dem Wasserstoffatom vereinigt, erhält $O$ das gleiche Oktett wie das Neon Edelgas und $H$ die stabile Struktur von Helium !
Indem es die zwei Elektronen seines Dubletts mit dem Wasserstoffatom vereinigt, erhält $O$ das gleiche Oktett wie das Neon Edelgas und $H$ die stabile Struktur von Helium !
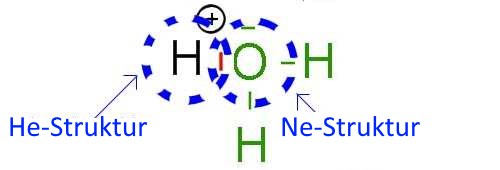 Es muss jedoch gut verstanden werden, dass durch das Zusammenlegen von zwei Elektronen die aus dem O-Atom stammen, diesem im Durchschnitt ein Elektron verloren geht, während H eins erhält, so dass O, anfangs neutral, jetzt eine positive Ladung erhält, während H, positiv geladen am Anfang, jetzt neutral wird:
Es muss jedoch gut verstanden werden, dass durch das Zusammenlegen von zwei Elektronen die aus dem O-Atom stammen, diesem im Durchschnitt ein Elektron verloren geht, während H eins erhält, so dass O, anfangs neutral, jetzt eine positive Ladung erhält, während H, positiv geladen am Anfang, jetzt neutral wird:

Eine dative Bindung kann zwischen einer chemischen Spezies mit einer elektronischen Lücke und einer Spezies mit einem elektronischen Dublett gebildet werden. Die erste Spezies gewinnt durchschnittlich ein Elektron, und ihre Ladung nimmt somit um eine Einheit ab, die zweite verliert ein Elektron und ihre Ladung nimmt um eine Einheit zu.
Hier sind verschiedene Fälle von Elektronenlücken:
- Das Wasserstoffion, zum Beispiel:
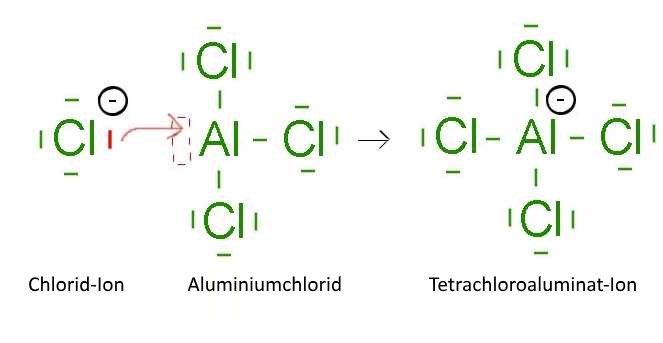
 - Die zusammengesetzte Substanzen der Borgruppe (dritte Familie der Periodentafel): $B$, $Al$, ..., zum Beispiel:
- Die zusammengesetzte Substanzen der Borgruppe (dritte Familie der Periodentafel): $B$, $Al$, ..., zum Beispiel:
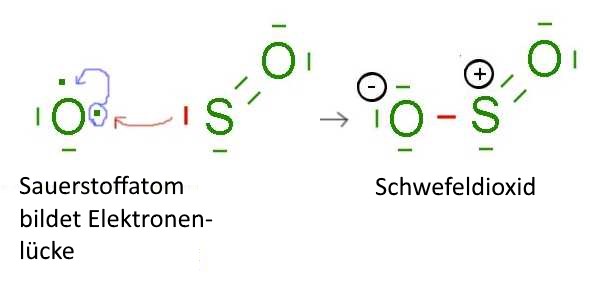
 - Die Atome der Chalkogene (sechste Familie der Periodentafel): $O$, $S$,.... nach Umlagerung ihrer äußeren Elektronen zum Beispiel:
- Die Atome der Chalkogene (sechste Familie der Periodentafel): $O$, $S$,.... nach Umlagerung ihrer äußeren Elektronen zum Beispiel: