Suche:
Nach der Oktettregel versucht ein Atom durch das Geben oder Akzeptieren von Elektronen häufig die elektronische Struktur $1s^2 $ (erste Periode) oder $ns^2 \;np^6$ (andere Perioden) anzunehmen . Daher die folgenden elementaren Ionenn:
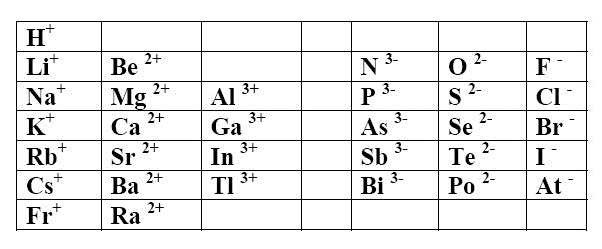
Einfache positive Ionen (Katione) haben den Namen des Elementes
$Li^+$ ist das Lithiumion (oder -kation) $Ca^{2+}$ ist das Calciumion (oder -kation)
Einfache negative Ionen (Anione) enden mit -id
Beispiele: $Cl^-$ ist das Chloridion (oder -anion) $Se^{2-}$ ist das Selenidion (oder -anion)
Alle vorherigen Ionen sind farblos.
Die durch die Übergangselemente oder durch einige schwere Elemente gebildeten Ionen gehorchen nicht der Oktettregel.
Sie haben manchmal eine charakteristische Farbe (die aber von denen sie umgebenden Ionenn beeinflusst werden kann):


Kristall welches das $Cu^{2+}$-ion enthält
Die mehratomige Ionen haben manchmal eine charakteristische Farbe (die jedoch durch ihre Umgebung beeinflusst werden kann):


Kristalle welche das $Cr_2O_7^{2-}$-ion enthalten
Die Addition eines $ H^+ $ -Kations an ein mehrfach negativ geladenes Anion führt zu einem Anion, dessen negative Ladung um eine Einheit verringert ist . Beispiele: $HPO_4^{2-}$ ist das Anion (Mono)hydrogenophosphat $H_2PO_4^{-}$ ist das Anion Dihydrogenophosphat $HS^{-}$ ist das Anion Hydrogenosulfid
HydrogenoAnione: Präfixe: Hydrogen(o) Multiplicative: (Mono), Di Tri (Das Präfix "Mono" ist facultativ)
Die Addition eines $ H^+$ - Kations an ein einladiges negatives Anion führt nicht mehr zu einem Ion, sondern zum neutralen Molekül einer Substanz namens Säure . Beispiele: $HClO_4$ ist die Perchlorsäure $HClO_3$ ist die Chlorsäure $HClO_2$ ist die Chlorige Säure $HClO$ ist die Hypochlorige Säure $HCl$ ist die Chlorwasserstoffsäure) oder Salzsäure
Anion auf -id → Säure auf -wasserstoffsäure) Anion auf -it → Säure auf -ige Säure Anion auf -at → Säure auf -säure
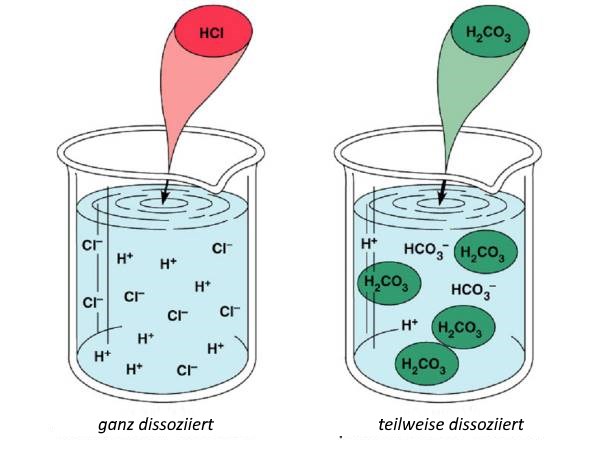
In Wasser eingeführt dissoziieren die Säuremoleküle vollständig oder teilweise zu Ionenn:
Beispiele:
$HCl$  $H^+$ $+$ $Cl^-$
(Komplette Dissoziierung: "starke" Säure)
$H_2CO_3$
$H^+$ $+$ $Cl^-$
(Komplette Dissoziierung: "starke" Säure)
$H_2CO_3$  $H^+$ $+$ $HCO_3^-$
(Teildissoziierung: "schwache" Säure)
$HF$
$H^+$ $+$ $HCO_3^-$
(Teildissoziierung: "schwache" Säure)
$HF$  $H^+$ $+$ $F^-$
(Teildissoziierung: "schwache" Säure)
$H^+$ $+$ $F^-$
(Teildissoziierung: "schwache" Säure)