







Das Permanganation (lila) hat die Formel $ MnO_4^- $. Berechnen Sie die Oxidationszahl vom Mangan!
Sei x die Oxidationszahl vom Mangan: $x$ $+$ $4(-2)$ $=$ $-1$, also $x$ $=$ $7$
Das Manganation (grün) hat die Formel $MnO_4^{2-} $. Berechnen Sie die Oxidationszahl vom Mangan!
Sei x die Oxidationszahl vom Mangan: $x$ $+$ $4(-2)$ $=$ $-2$, also $x$ $=$ $6$
Das MischOxid-Hydroxid von Mangan (braun) hat die Formel $ MnO(OH) _2 $. Berechnen Sie die Oxidationszahl von Mangan!
$x$ $+$ $(-2)$ $+$ $2(-2+1)$ $=$ $0$, also $x$ $=$ $4$
Was ist mit dem Mangan während dieser Reaktion passiert??
Mangan wurde reduziert, so dass es Elektronen gewann!
Berechnen Sie die Oxidationszahl des angefärbten Kohlenstoffatoms in Glucose und in der gebildeten Gluconsäure!
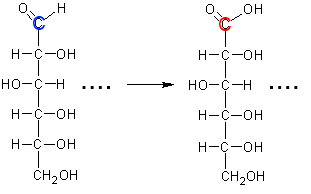
Wir verhalten uns so, als ob das elektronegativere Atom in jeder Bindung alle Elektronen dieser Bindung hätte:
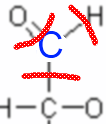 Der Kohlenstoff "hat" hier also 3 Elektronen in der letzten Schicht, mit 4 ist er neutral, also ist seine fiktive Ladung (Oxidationszahl) +1
Der Kohlenstoff "hat" hier also 3 Elektronen in der letzten Schicht, mit 4 ist er neutral, also ist seine fiktive Ladung (Oxidationszahl) +1
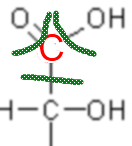
Also hat der Kohlenstoff hier 1 Elektron in der letzten Schicht, mit 4 ist er neutral, also ist seine fiktive Ladung (Oxidationszahl) +3
Was ist mit diesem Kohlenstoff während der Reaktion passiert?
Der Kohlenstoff wurde oxidiert, also hat er Elektronen verloren.