La réaction apparemment simple de corrosion du zinc par un acide $Zn+2H^+$ $\rightarrow$ $Zn^{2+}+H_2$ pose bien des problèmes de compréhension: 1) Est-il possible que les ions positifs Zn et H diffusent constamment en sens contraire, les ions $Zn^{2+}$ à partir du zinc solide vers la solution, les ions $H^+$ de la solution vers le zinc ? La physique nous enseigne que des charges positives se déplacent toujours dans un sens dans un champ électrique ! 2) Comment se fait-il que la réaction soit beaucoup plus rapide avec du zinc impur (renfermant des traces d'autres métaux) qu'avec du zinc très pur? 3) Comment expliquer que l'addition d'un peu de sulfate de cuivre augmente considérablement la vitesse de la réaction (catalyseur)? Regardons la surface d'un morceau de zinc souillé par un grain de cuivre (impureté présente dès le début ou formée par l'action de $Cu^{2+}$ sur Zn )et plongé dans une solution acide:

Ce système est équivalent à une pile:

En effet, le conducteur ( court-circuit!) est assuré par le zinc lui-même et les ions $Zn^{2+}$ ainsi que les molécules $H_2$ se formeront dès le passage des premiers électrons, alors que les ions $H^+$, repoussés par les ions $Zn^{2+}$ ne peuvent plus attaquer directement le zinc ( rôle de la paroi semi-perméable dans la pile )! La pile locale fonctionnera jusqu'à épuisement du zinc ou des ions $H^+$.
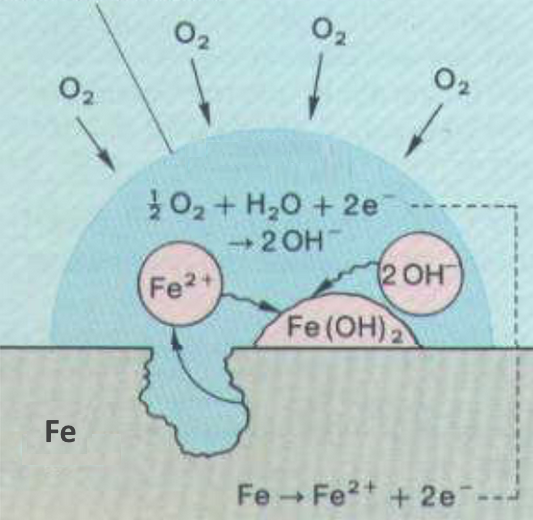
L'expérience montre que l'eau et l'oxygène sont nécessaires pour la formation de la rouille. Des impuretés dans l'air ( $CO_2$, $SO_2$ poussières ) ainsi que des sels dans l'eau favorisent le processus. Une pile locale explique ce qui se passe: Dans les régions pauvres en oxygène, le fer entre en solution sous forme d'ion fer(II). ( Electrode négative de la pile ). Il laisse 2 électrons qui peuvent circuler dans le corps du métal ( circuit "extérieur" de la pile ). A la surface du fer, aux endroits où la solution est riche en oxygène ( Electrode positive de la pile ), ce dernier capte des électrons pour former des ions hydroxyde avec l'aide de l'eau. Ions fer(II) et ions hydroxyde diffusent l'un vers l'autre dans le solution: $Fe^{2+}(OH^-)_2$ précipite. Ensuite, l'excès d'oxygène oxyde l'hydroxyde de fer(II) en rouille: $4Fe(OH)_2 + O_2$ $\rightarrow$ $2Fe_2O_3.H_2O + 2H_2O$ La rouille est poreuse et permet ainsi que le processus continue jusqu'à la disparition du fer.