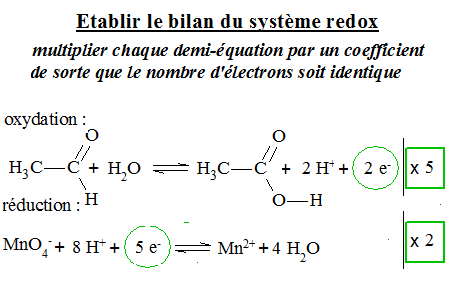Le nombre d'oxydation d'un atome dans une molécule
C'est une charge fictive. On fait comme si l'atome avait entièrement accaparé les électrons de la liaison où il est le partenaire le plus électronégatif ou perdu les électrons de la liaison où il est le partenaire le moins électronégatifet et on détermine alors sa charge: C'est le n.o.
Si les deux atomes sont identiques, on partage les électrons de liaison.
Exemple:
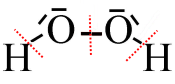
Ici, on a attribué 7 $e^-$ extérieurs à chaque atome $O$ alors que dans sa → structure neutre de Lewis il n'en a que 6.
Sa charge fictive (son n.o.) est donc -1
On a attribué 0 $e^-$ extérieurs à chaque atome $H$ alors que dans sa → structure neutre de Lewis il en a 1.
Sa charge fictive (son n.o.) est donc +1
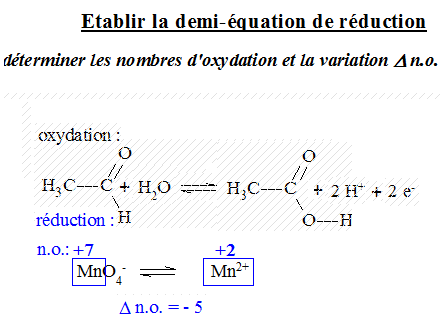
La variation du nombre d'oxydation
Si le n.o. augmente de n unités, l'espèce perd n $e^-$
Si le n.o. diminue de n unités, l'espèce gagne n $e^-$
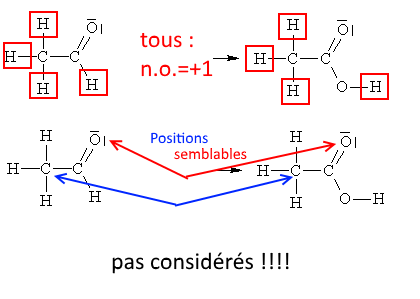
Inutile de considérer des atomes qui sont dans des positions semblables ou des atomes $H$ attachés à un autre atome, par exemple:
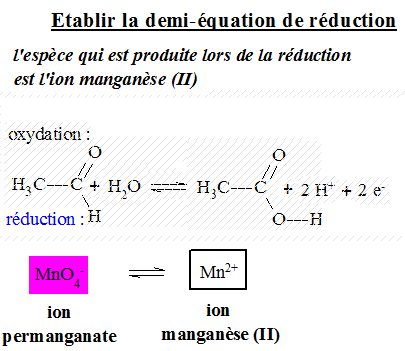
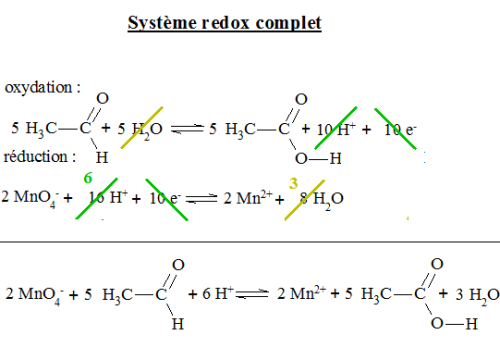
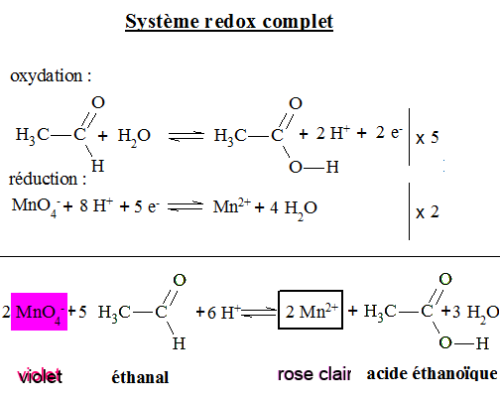
Étudions la réaction du permanganate de potassium sur l'éthanal en présence d'acide sulfurique: