





Supposons que nous disposons d'une bulle de gaz entourée d'une paroi mince et flexible maintenue à température constante dans le liquide:

1er cas: Au début, la pression à l'intérieur de la bulle est inférieure à la pression du liquide (pression ambiante):

La bulle va se contracter jusqu'à ce que (Loi de Boyle et Mariotte: Volume diminue, donc pression augmente!) sa pression égale celle du liquide.
2e cas: Au début, la pression à l'intérieur de la bulle est supérieure à la pression du liquide (pression ambiante):
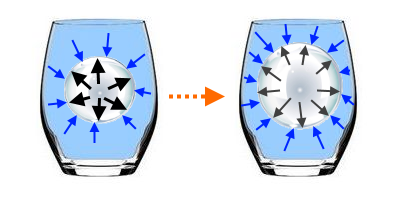
La bulle va se dilater jusqu'à ce que (Loi de Boyle et Mariotte: Volume augmente, donc pression diminue!) sa pression égale celle du liquide.
Supposons qu'une bulle de vapeur se trouve dans son liquide (même substance) sans qu'il y ait de paroi de séparation:
1er cas: $P_o\;\lt\;P$ (*) Au début, la pression de vapeur saturante de la bulle est inférieure à la pression du liquide (pression ambiante):
La bulle va se contracter pour essayer d'avoir une pression égale celle du liquide. Mais par contre, la pression de vapeur saturante se maintient (parce que ni la température, ni la nature de la substance ne changent) et nous sommes ramenés à la condition (*) La contraction va continuer, jusq'à ce que toute la vapeur se trouve condensée!

$P_o\;\lt\;P$ $\longrightarrow$ disparition des bulles par condensation!
2e cas: $P_o\;\gt\;P$ (**) Au début, la pression de vapeur saturante de la bulle est supérieure à la pression du liquide (pression ambiante):
La bulle va se dilater pour essayer d'avoir une pression égale celle du liquide. Mais par contre, la pression de vapeur saturante se maintient (parce que ni la température, ni la nature de la substance ne changent) et nous sommes ramenés à la condition (**) La dilatation va continuer et aboutit à l'ébullition du liquide !

$P_o\;\gt\;P$ $\longrightarrow$ multiplication des bulles par ébullition!.
Nous venons de voir - qu'en élevant la d'une substance liquide , on augmente sa pression de vapeur saturante. - que l'ébullition d'une substance liquide doit commencer au moment où la pression ambiante est égale à sa pression de vapeur saturante.
La température d'ébullition d'une substance est la température pour laquelle la pression de vapeur saturante est égale à sa pression ambiante!.

Le diagramme représente les pressions de vapeur saturante de trois liquides en fonction de la température: 1 Éther 2 Éthanol 3 Eau Les températures d'ébullition pour une pression ambiante de $101,3\;kPa$ (niveau de la mer) sont déterminées (pointillé bleu). On remarque encore que plus la pression vapeur saturée est élevée à une température donnée, p.ex la température ambiante (pointillé vert), plus la température d'ébullition est basse (pointillé orange)
La température d'ébullition d'une substance est d'autant plus basse que sa pression vapeur saturante à une température donnée est élevée.
Exercice Déterminer sur le graphique précédent les températures d'ébullition des trois liquides 1. au Mont Everest $(P=253\;torr)$ 2. au Mont Blanc $(P=0,54\;atm)$