





Les principaux processus qui conduisent à la formation de minéraux sont les suivants: • Cristallisation d'un liquide qui, par refroidissement, passe de l'état liquide à solide. Exemples : passage de l'eau à la glace; cristallisation par refroidissement d'un magma. • Précipitation chimique à partir d'une solution sursaturée par rapport à un minéral. Exemples : la formation des agathes; la formation des dépôts de cavernes, les minéraux de la séquence évaporitique. • Cristallisation de vapeurs. Exemple : la cristallisation du soufre autour des fumerolles (émanations de gaz riches en H2S provenant de la chambre magmatique) sur les volcans.
Chaque minéral possède son point de fusion qui correspond aussi à son point de cristallisation à une pression donnée. Plusieurs minéraux de la croûte terrestre cristallisent à partir d'un magma, c'est-à-dire, de la roche fondue. Cette cristallisation obéit à certaines règles. Dans un magma dont la température est supérieure à 1200° C, comme au niveau du manteau supérieur par exemple, les minéraux sont tous sous leur phase liquide. Si ce magma est introduit dans la croûte terrestre, il subit un abaissement de pression et se refroidit progressivement. Avec un abaissement de la température du magma, les minéraux dont la température de cristallisation devient progressivement plus basse cristallisent. L’ordre de cristallisation est le suivant : 1) Olivine. 2) Pyroxènes. 3) Amphiboles 4) Biotite. 5) Quartz, 6) Feldspaths 7) Muscovite
L’olivine

Un pyroxène : l’augite

Un amphibole : la hornblende

La biotite

Un feldspath

La muscovite

Au fur et à mesure que les minéraux cristallisent dans la chambre magmatique c.à.d. dans la poche où s'est introduit le magma, les cristaux sédimentent, s'accumulent à la base de la chambre. Il se fait donc une ségrégation, et les roches issues de la cristallisation du magma (roches ignées) auront des assemblages de minéraux différents selon qu'on est à la base, au milieu ou au sommet de la chambre magmatique.

Il y a toutes sortes de solutions aqueuses qui circulent dans les roches de la croûte terrestre. Elles peuvent provenir des zones chaudes du manteau et être constituées de l'excès de vapeur d'eau d'un magma. Ou encore, il peut s'agir de l'eau qui avait été piégée dans les bassins sédimentaires profonds. Les belles agathes qu'on nous vend dans les boutiques de minéraux ont été formées par la précipitation de minéraux dans une cavité de la roche, à partir d'une solution.

L'eau provient de la surface, par infiltration à travers les fractures du calcaire. Lors de la dissolution des calcaires (1).. $Ca^{2+}CO_3^{2-}$ $+$ $H_2O$ $+$ $CO_2$ $\rightarrow$ $Ca^{2+}$ $+$ $2HCO_3^{-} $ L'eau se charge en $CO_2$, ions calcium ($Ca^{2+}$) et ions hydrogénocarbonate $HCO_3^{-}$ . Dans les roches juste au-dessus de la caverne, la pression du $CO_2$ contenu dans la solution est à plusieurs atmosphères, à cause du poids de la roche. Lorsque la solution suinte dans la caverne, sa pression diminue subitement. Il se produit alors le phénomène du dégazage du $CO_2$ : $Ca^{2+}$ $+$ $2HCO_3^{-}$ $\rightarrow$ $Ca^{2+}CO_3^{2-}$ $+$ $H_2O$ $+$ $CO_2$ La calcite $CaCO_3$ précipite, il y a formation de stalactites (2) et de stalagmites (3).
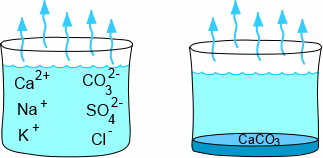
L'eau de mer contient une panoplie importante d'ions en solution, dont des ions positifs tels le calcium, le sodium et le potassium, des ions négatifs tels les ions chlorure, carbonate et sulfate. L'évaporation ne se débarasse que de l'eau, ce qui fait qu'au fur et à mesure de l'évaporation, les sels se concentrent de plus en plus. L'eau de mer est légèrement sursaturée par rapport au carbonate de calcium, $CaCO_3$ . Ce dernier précipite naturellement et dépose une couche de cristaux de $CaCO_3$ (calcite ou aragonite) au fond du bocal.

Avec la poursuite de l'évaporation et par conséquent l'augmentation de la salinité, la solution devient sursaturée par rapport à un autre sel, le $CaSO_4$ hydraté (gypse); la solution (le milieu) est dite pénésaline. Le gypse précipite. Puis, avec encore une augmentation de la salinité, vient la phase de précipitation du chlorure de sodium, NaCl (halite, le sel commun); la solution (le milieu) est dite saline.

La dernière phase avant l'évaporation totale est le chlorure de potassium, KCl (sylvite, communément appelée potasse); la solution (le milieu) est hypersaline. On obtient donc une suite bien spécifique de minéraux précipités à mesure de l'évaporation de l'eau de mer. Ce sont les évaporites.

Dans la nature, la précipitation des minéraux évaporitiques se fait, entre autre, dans les grandes lagunes en bord de mer, lagunes qui se mesurent en plusieurs dizaines ou centaines de kilomètres carrés, dans des régions où l'évaporation excède la précipitation.