Les molécules d'eau peuvent former des ponts hydrogène vers l'atome O du groupe carbonyle. Cela explique la solubilité des aldéhydes et cétones à petite chaîne d'atomes C dans l'eau.
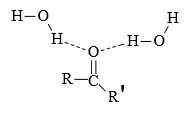
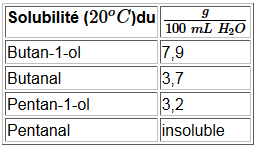
La solubilité est cependant moins grande que celle des alcools correspondants qui sont à la fois donneurs et accepteurs de ponts H par rapport à l'eau.

Aucun pont $H$ n'assure une forte attraction mutuelle des aldéhydes ou cétones (la polarité de la liaison $C-H$ est trop faible !).
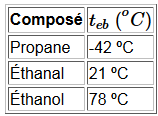
Ces substances sont donc plus volatiles que les alcools de masse molaire comparable.
Reste l'attraction plus faible dipôle-dipôle des groupes carbonyles qui assure des températures d'ébullition néansmoins plus élevées que celles des hydrocarbures correspondants qui ne s'associent que par les faibles forces de Van der Waals.
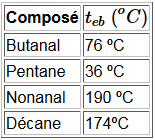
 L'inertie augmente avec la masse molaire, donc la volatilité diminue:
L'inertie augmente avec la masse molaire, donc la volatilité diminue:
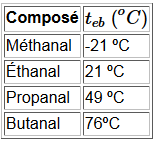 Au fur et à mesure que la chaîne d'atomes $C$ se rallonge, le caractère hydrophobe de la chaîne hydrocarbonée l'emporte sur le caractère hydrophile du groupement carboxyle et la volatilité des aldéhydes et cétones se rapproche de plus en plus de celle des alcanes de masses molaires comparables:
Au fur et à mesure que la chaîne d'atomes $C$ se rallonge, le caractère hydrophobe de la chaîne hydrocarbonée l'emporte sur le caractère hydrophile du groupement carboxyle et la volatilité des aldéhydes et cétones se rapproche de plus en plus de celle des alcanes de masses molaires comparables: