





- Le $pH$ d'une solution aqueuse $1\; M$ d'acide éthanoïque vaut $2,4$, celui d'une solution d'acide chlorhydrique (entièrement dissocié) $1\; M$ vaut $0$: La dissociation de l'acide éthanoïque est faible ! - $1\; mol$ d'éthanoïque est neutralisée par $1\; mol$ d'hydroxyde de sodium: Des quatre atomes $H$ de $CH_3COOH$, un seul est acide !
Il faut admettre que les acides carboxyliques se dissocient suivant (théorie d'Arrhénius):
$R-COOH$ $\leftrightarrows$ $R-COO^-$ $+$ $H^+ $
En réalité, les ions hydrogène $H^+$ résultant de cette dissociation sont immédiatement repris par l'eau en formant des ions hydronium (théorie de Broenstedt):
$R-COOH$ $+$ $H_2O$ $\leftrightarrows$ $R-COO^-$ $+$ $H_3O^+ $
Les équations des réactions acides de ces substances seront donc présentées selon le contexte - soit sous forme non ionique, par exemple: $CH_3COOH$ $+$ $NaOH$ $\rightarrow$ $CH_3COONa$ $+$ $H_2O$ - soit sous forme ionique simplifiée, par exemple: $CH_3COO^-$ $+$ $H^+$ $+$ $Na^+$ $+$ $OH^-$ $\rightarrow$ $CH_3COO^-$ $+$ $Na^+$ $+$ $H_2O$ - soit sous forme ionique complète, par exemple: $CH_3COO^-$ $+$ $H_3O^+$ $+$ $Na^+$ $+$ $OH^-$ $\rightarrow$ $CH_3COO^-$ $+$ $Na^+$ $+$ $2H_2O$
On peut invoquer trois causes de l'acidité du groupement carboxyle: 1) L'effet -I du groupement carbonyle:

Cet effet renforce la polarisation de la liaison $O-H$ , ce qui rend plus facile le départ de $H^+$ 2) La mésomérie du groupement carboxyle:
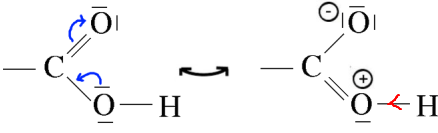
L'apparition d'une charge positive sur l'oxygène dans une forme contributive renforce la polarisation de la liaison $O-H$ , ce qui rend plus facile le départ de $H^+$ 3) La mésomérie de l'ion carboxylate:

Cette mésomérie est parfaite parce que les deux formes contributives ont même probabilité. L'ion carboxylate est donc considérablement stabilisé par mésomérie, ce qui déplace l'équilibre de dissociation acide de son côté, donc vers le départ de $H^+$.

Les chaînes $R$ qui exercent un effet $+I$ sur le groupement carboxyle diminuent la polarité de la liaison $O-H$ et rendent le départ de $H^+$ plus difficile, par exemple:

Rappels: Plus le $pK_a$ est grand, plus l'acide est faible. La chaîne hydrocarbonée exerce un effet $+I$ d'autant plus fort qu'elle est longue ou ramifiée.
Les chaînes $R$ qui exercent un effet $-I$ sur le groupement carboxyle augmentent la polarité de la liaison $O-H$ et rendent le départ de $H^+$ plus facile, par exemple:

Rappel: E.n.(F)>E.n.(Cl)>E.n.(Br)>E.n.(I)>
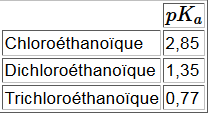
Effet du nombre d'atomes électronégatifs

Effet de la distance des atomes électronégatifs