







Recherche:

Chlorure de nickel(II)
|
1. $H_2S$ |
|
pas de précipitation en milieu acide |
|
2. $(NH_4)_2S$ |
|
$Ni^{2+}$ $+$ $S^{2-}$ $\longrightarrow$ $NiS$ - précipité noir - soluble dans $HCl$ - soluble dans $HCl-HNO_3$/ glomérule S ! |
|
3. $KOH$ |
|
$Ni^{2+}$ $+$ $2OH^-$ $\longrightarrow$ $Ni(OH)_2$ - précipité vert gélatineux - soluble dans les acides minéraux dilués - insoluble dans un excès de réactif - s'oxyde en présence d'oxydants, p. ex. $Br_2$ : $Ni(OH)_2$ $+$ $Br_2$ $+$ $2OH^-$ $\longrightarrow$ $2Br^-$ $+$ $2Ni(OH)_3$ - précipité noir |
|
4. $NH_3$ |
|
$Ni^{2+}+2OH^- \longrightarrow Ni(OH)_2$ - précipité vert - avec un excès de $NH_3$, il y a complexation: $Ni(OH)_2 ..$ $\longrightarrow$ $ ..[Ni^{II}(NH_3)_6]^{2+}$ - cation hexamminenickel(II), soluble, mauve |
|
5. $KCN$ |
|
$Ni^{2+}$ $+$ $2CN^-$ $\longrightarrow$ $Ni(CN)_2$ - précipité vert - avec un excès de $CN^-$, il y a complexation: $Ni(CN)_2 ..\longrightarrow ..[Ni^{II}(CN_4)]^{2-}$ - anion tétracyanonickelate(II), soluble, jaune - la réaction masque tous les autres réactifs du $Ni^{2+}$ |
|
6. Diméthylglyoxime |
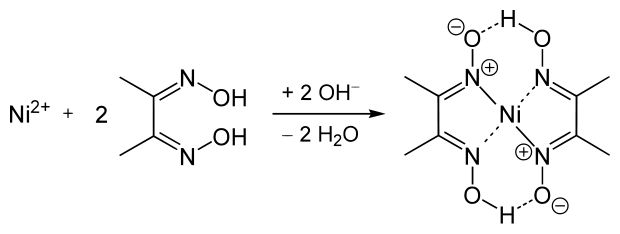
- chélate bis(diméthylglyoximato)nickel, rouge framboise - soluble dans les acides minéraux dilués - insoluble dans l'acide acétique - le milieu ammoniacal favorise la précipitation - éviter les acides minéraux et les oxydants |