





On appelle système une portion de matière qui subit des transformations. On appelle milieu extérieur tout ce qui entoure le système.
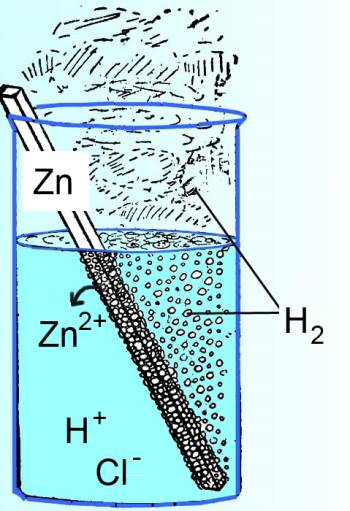
Dans le cas illustré, le système est constitué par les réactifs et les produits (en noir), le milieu extérieur par le solvant, le récipient et l'air environnant (en bleu).
On dit qu'un système est isolé, si aucun échange avec le milieu extérieur n'est possible. Un sytème non isolé échange de la chaleur et (ou) du travail avec le milieu extérieur.
Dans le cas illustré en haut, le système n'est pas isolé: - L'eau s'échauffe par suite de la réaction chimique: Le milieu extérieur reçoit de la chaleur de la part du système. - L'eau et l'air sont "écartés" par le (di)hydrogène formé: Le milieu extérieur reçoit du travail de la part du système.
Conventionnellement,on attribue le signe + à tout ce que le système reçoit , le signe - à ce qu'il cède.
Dans le cas illustré en haut, chaleur et travail sont négatifs
L'état d'un système est décrit par une valeur unique de ses paramètres d'état qui sont: - la pression $P$ - la température $T$ - le volume $V$ - les quantités (nombres de moles) $n_i$ des espèces chimiques présentes
On mélange 2 moles de (di)hydrogène avec 1 mole de (di)oxygène sous les conditions normales de température et de pression (n.t.p.). On déclenche la réaction qui forme de l'eau. On recueille l'eau formée à $4^oC$:
État initial: Paramètres d'état: $P_1$ $=$ $1 atm$ $T_1$ $=$ $273,15 K$ $V_1$ $=$ $3\cdot 22,4L$ $n_{H_2}$ $=$ $2$ $n_{O_2}$ $=$ $1$ $n_{H_2O}$ $=$ $0$ État final: Paramètres d'état: $P_2=1 atm$ $T_2=277,15 K$ $V_2=36mL$$n_{H_2}=0$ $n_{O_2}=0$ $n_{H_2O}=2$