







Recherche:
Une molécule est un édifice bien plus complexe qu'un atome isolé.
Mais les physiciens ont prouvé qu'on peut prévoir les orbitales moléculaires à partir des orbitales atomiques:
 - Deux orbitales $1s$ (p.ex. de deux atomes d'hydrogène séparés) renferment chacune un électron (symbolisé par une flèche).
Pour établir une liaison (p.ex. $H-H$), ces deux orbitales "fusionnent" frontalement pour former une orbitale appartenant à la nouvelle molécule.
Cette orbitale moléculaire est appelée orbitale $\sigma$ (sigma) et renferme les deux électrons de départ.
- Deux orbitales $1s$ (p.ex. de deux atomes d'hydrogène séparés) renferment chacune un électron (symbolisé par une flèche).
Pour établir une liaison (p.ex. $H-H$), ces deux orbitales "fusionnent" frontalement pour former une orbitale appartenant à la nouvelle molécule.
Cette orbitale moléculaire est appelée orbitale $\sigma$ (sigma) et renferme les deux électrons de départ.
 - Deux orbitales $2p_y$ orientées suivant le même axe (p.ex. de deux atomes d'oxygène séparés) renferment chacune un électron (symbolisé par une flèche).
Pour établir une liaison (p.ex. $O-O$), ces deux orbitales "fusionnent" frontalement pour former une orbitale appartenant à la nouvelle molécule.
Cette orbitale moléculaire est encore appelée $\sigma$ (sigma)et renferme les deux électrons de départ.
(Attention! Le dessin en haut renferme une seule orbitale $\sigma$ !
- Deux orbitales $2p_y$ orientées suivant le même axe (p.ex. de deux atomes d'oxygène séparés) renferment chacune un électron (symbolisé par une flèche).
Pour établir une liaison (p.ex. $O-O$), ces deux orbitales "fusionnent" frontalement pour former une orbitale appartenant à la nouvelle molécule.
Cette orbitale moléculaire est encore appelée $\sigma$ (sigma)et renferme les deux électrons de départ.
(Attention! Le dessin en haut renferme une seule orbitale $\sigma$ !
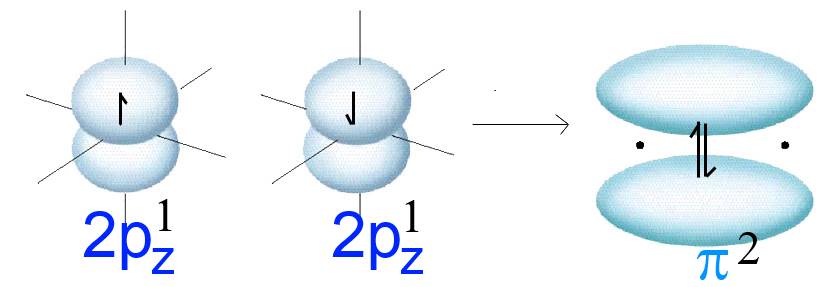 - Deux orbitales $2p_z$ orientées parallèlement (p.ex. de deux atomes d'oxygène séparés) renferment chacune un électron (symbolisé par une flèche).
Pour établir une liaison ces deux orbitales "fusionnent" pour former une orbitale appartenant à la nouvelle molécule.
Cette orbitale moléculaire est appelée $\pi$ (pi) et renferme les deux électrons de départ.
(Attention! Le dessin en haut renferme une seule orbitale $\pi$)
- Deux orbitales $2p_z$ orientées parallèlement (p.ex. de deux atomes d'oxygène séparés) renferment chacune un électron (symbolisé par une flèche).
Pour établir une liaison ces deux orbitales "fusionnent" pour former une orbitale appartenant à la nouvelle molécule.
Cette orbitale moléculaire est appelée $\pi$ (pi) et renferme les deux électrons de départ.
(Attention! Le dessin en haut renferme une seule orbitale $\pi$)