







Recherche:
→ Table des électronegativités
Les atomes à faible électronégativité cèdent facilement leurs électrons, ceux à forte électronégativité les retiennent bien.
Si la différence d'électronégativité entre deux atomes dépasse 2 les atomes forment une liaison ionique.
Par exemple $E.n.(Cl)-E.n.(Na) = 2,1 $, donc le chlorure de sodium est une substance ionique.

Deux atomes possédant tous les deux des électronégativités supérieures ou égales à 2 forment entre eux une liaison covalente.
Par exemple $E.n.(H), E.n.(O) > 2$, donc l'eau est une substance moléculaire.

Les atomes possédant tous des électronégativités inférieures à 2 s'associent en liaisons métalliques.
Par exemple $E.n.(Na)=0,9 2$, donc le sodium est un métal.
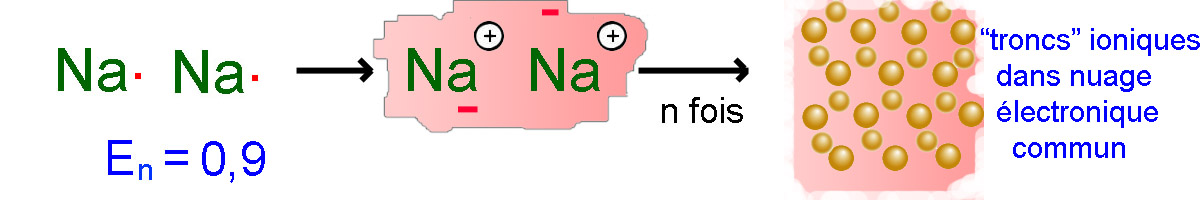
La limite de 2 que nous nous sommes fixée est assez floue. Aux abords de cette limite, des cas intermédiaires sont fréquents, par exemple - dans un échantillon de chlorure de fer(III) $(\Delta(E.n.)$ $=$ $1,2)$ il existe des molécules $FeCl_3$, mais aussi des ions $Fe^{3+}$ et $Cl^-$! - l'or $(E.n.$ $=$ $2.4)$ est un métal!