Recherche:
Suivant la règle de l'octet, en cédant ou en acceptant des électrons, un atome cherche souvent à adopter la structure électronique $1s^2$ (première période) ou $ns^2 np^6$ (autres périodes). D'où les ions élémentaires suivants:
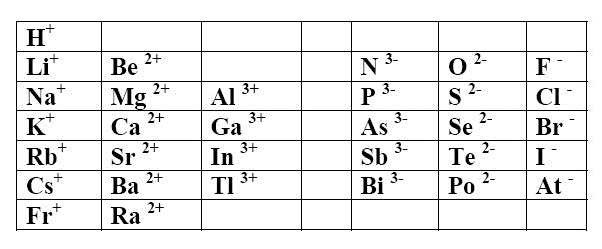
Les ions positifs (cations) simples ont le nom de l'élément
$Li^+$ est l'ion (ou cation) lithium $Ca^{2+}$ est l'ion (ou cation) calcium
Les ions négatifs (anions) simples prennent la terminaison -ure Exceptions: $O^{2-}$ est l'ion oxyde $P^{3-}$ est l'ion phosphure $N^{3-}$ est l'ion nitrure $S^{2-}$ est l'ion sulfure
Exemples: $Cl^-$ est l'ion (ou anion) chlorure $Se^{2-}$ est l'ion (ou anion) séléniure
Tous les ions précédents sont incolores.
Les ions formés par les éléments de transition ou par quelques éléments lourds n'obéissent pas à la règle de l'octet.
Ils possèdent parfois une couleur caractéristique (qui peut cependant être influencée par leur entourage):
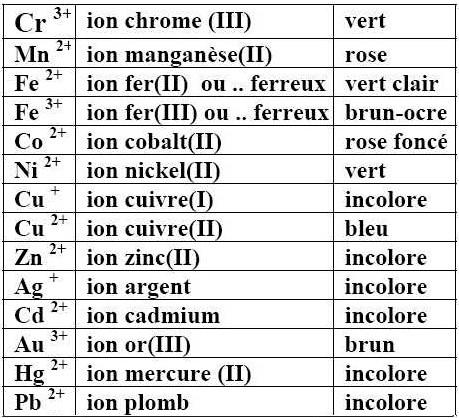

Cristal renfermant l'ion $Cu^{2+}$
Les ions composés possèdent parfois une couleur caractéristique (qui peut cependant être influencée par leur entourage):
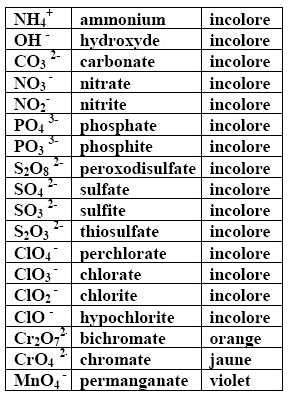

Cristaux renfermant l'ion $Cr_2O_7^{2-}$
L'addition d'un cation $H^+$ à un anion à charge négative multiple conduit à un anion dont la charge négative est diminuée d'une unité. Exemples: $HPO_4^{2-}$ est l'anion (mono)hydrogénophosphate $H_2PO_4^{-}$ est l'anion dihydrogénophosphate $HS^{-}$ est l'anion hydrogénosulfure
Anions hydrogénés: Préfixe: hydrogéno Multiplicatifs: (mono), di tri (Le préfixe "mono" est facultatif)
L'addition d'un cation $H^+$ à un anion à charge négative simple ne conduit plus à un ion, mais à la molécule neutre d'une substance appelée acide. Exemples: $HClO_4$ est l'acide perchlorique $HClO_3$ est l'acide chlorique $HClO_2$ est l'acide chloreux $HClO$ est l'acide hypochloreux $HCl$ est l'acide chlorhydrique
Anion en -ure → acide en -hydrique Anion en -ite → acide en -eux Anion en -ate → acide en -ique
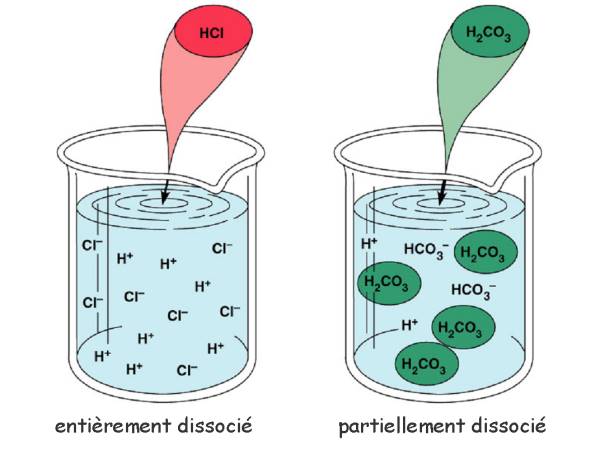
Introduits dans l'eau, les molécules d'acide se dissocient entièrement ou en partie pour former des ions:
Exemples:
$HCl$  $H^+$ $+$ $Cl^-$
(dissociation complète: acide "fort")
$H_2CO_3$
$H^+$ $+$ $Cl^-$
(dissociation complète: acide "fort")
$H_2CO_3$  $H^+$ $+$ $HCO_3^-$
(dissociation incomplète: acide "faible")
$HF$
$H^+$ $+$ $HCO_3^-$
(dissociation incomplète: acide "faible")
$HF$  $H^+$ $+$ $F^-$
(dissociation incomplète: acide "faible")
$H^+$ $+$ $F^-$
(dissociation incomplète: acide "faible")