





Une liaison covalente est dite polaire, si la différence entre les → électronégativités des deux atomes n'est pas nulle

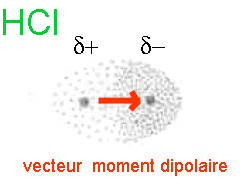
L'atome de chlore est plus électronégatif que l'atome d'hydrogène. Il attire plutôt vers lui les deux électrons de la liaison covalente.
Par la suite la partie de la molécule HCl entourant l'atome de chlore a un léger excédent de charge négative (noté δ-), évidemment inférieur à une charge élémentaire négative complète, comme dans l'ion Cl-.
La partie entourant l'atome d'hydrogène a un léger excédent de charge positive (noté δ+), évidemment inférieur à une charge élémentaire positive complète, comme dans l'ion H+.
Il apparaît un dipôle, grandeur vectorielle dirigée du δ+ vers le δ- (vecteur moment dipolaire)
 L'intensité du vecteur moment dipolaire dépend évidemment de la différence d'électronégativité entre les deux atomes:
L'intensité du vecteur moment dipolaire dépend évidemment de la différence d'électronégativité entre les deux atomes:
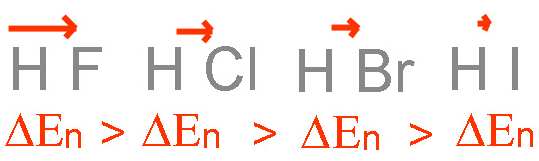
Les molécules possèdent souvent plusieurs vecteurs dipôles. Ces vecteurs s'additionnent pour former un moment dipolaire résultant (dipôle résultant).

La molécule d'eau possède un dipôle résultant dirigé vers l'atome d'oxygène, la molécule d'ammoniaque un dipôle résultant dirigé vers l'atome d'azote.
 Les dipôles résultants des molécules de méthane, tétrachlorure de carbone et éthane s'annullent parce que ces molécules sont symétriques.
Leur dipôle résultant résultant est nul.
Les dipôles résultants des molécules de méthane, tétrachlorure de carbone et éthane s'annullent parce que ces molécules sont symétriques.
Leur dipôle résultant résultant est nul.
On appelle molécule polaire toute molecule dont le dipôle résultant est non nul On appelle molécule apolaire (non polaire) toute molecule dont le dipôle résultant est nul
On appelle substance polaire toute substance dont les molécules sont polaires
On appelle substance apolaire (non polaire) toute substance dont les molécules sont apolaires
Mise en évidence d'une substance polaire:

La burette renferme de l'eau, le bâton d'ébonite est chargé négativement par
frottement. L'eau est attirée par le bâton chargé.
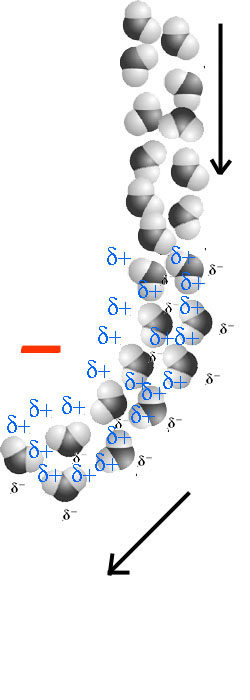
Sous l'influence de la charge négative, les molécules d'eau polaires s'orientent en tombant, le pôle δ+ formé par les deux atomes d'hydrogène bascule vers la charge négative. Puisque la distance de la charge négative au pôle δ+ est alors pour chaque molécule d'eau inférieure à la distance au pôle δ-, la force d'attraction prévaut sur la force de répulsion, les molécules d'eau sont attirées vers le bâton d'ébonite.

L'attraction est d'autant plus forte que les charges partielles δ+ et δ- sont élevées et que la distance entre les atomes qui s'attirent est petite.