





- Convertir éventuellement les données en moles - Raisonner en moles à partir de la signification de l'équation pour trouver le résultat en moles - Convertir le résultat dans l'unité requise
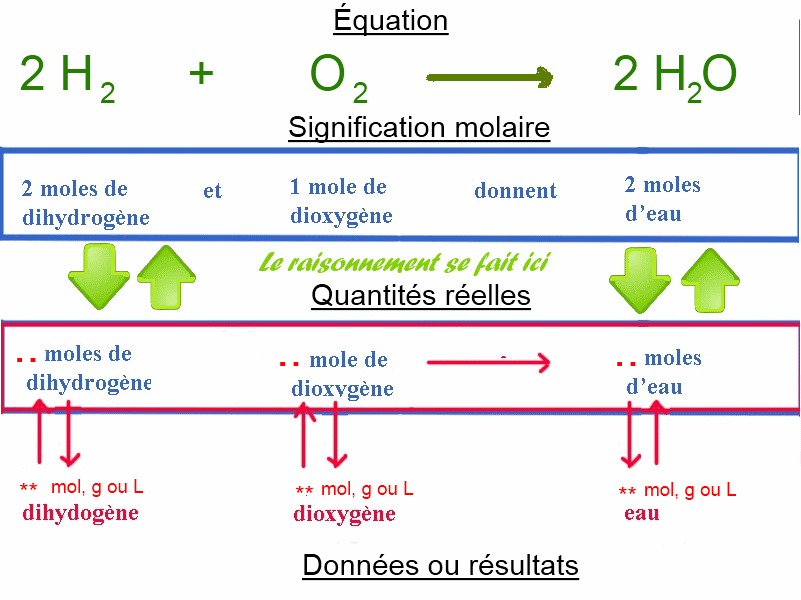
Exemple: Quelle masse d'eau peut-on obtenir à partir de 1,12 L CNTP de (di)oxygène? 1) Équation $2H_2$ $+$ $O_2$ $\longrightarrow$ $2H_2O$ 2) Conversion de la donnée en moles: $n_{O_2}$ $=$ $\frac{1,12}{22,4}$ $=$ $0,05$ 3) Signification de l'équation en moles: 2 moles $H_2$ + 1 mole $O_2$ → 2 moles $H_2O$ 4) Raisonnement: Si 1 mole de $O_2$ donne 2 moles $H_2O$, alors 0,05 moles $O_2$ donnent $0,05\cdot 2 = 0,1$ mole $H_2O$ 5) Conversion du résultat en g: $m_{H_2O}$ $=$ $n_{H_2O}\cdot M_{H_2O}$ $=$ $0,1\cdot18$ $=$ $1,8 g$